乙烷的发现和基本性质
发布日期:2022/12/20 14:11:50
乙烷(ethane) 烷烃同系列中第二个成员,为最简单的含碳-碳单键的烃。分子式C2H6,结构式为CH3CH3。乙烷在某些天然气中的含量为5%~10%,仅次于甲烷;并以溶解状态存在于石油中。
发现简史
1834年迈克尔·法拉第首次使用电解乙酸钾的方法制造了乙烷。他错误地以为这个反应的产物是甲烷,因此没有继续研究。
在1847年和1849年间阿道夫·威廉·赫尔曼·科尔贝和爱德华·弗兰克兰在维护有机化学理论的过程中通过使用金属钾还原丙腈和碘乙烷以及通过电解乙酸盐的方法制造了乙烷。但是他们错误地以为这些反应的产物是甲基自由基,而不是甲基的二聚体乙烷。
1864年卡尔·肖莱马校正了这个错误,他证明所有这些反应的产物都是乙烷。
基本性质
外观与性状:无色无臭气体。
熔点(℃):-183.3
沸点(℃):-88.6
相对密度(水=1):0.45
相对蒸气密度(空气=1):1.04
饱和蒸气压(kPa):53.32(-99.7℃)
燃烧热(kJ/mol):1558.3
临界温度(℃):32.2
临界压力(MPa):4.87
闪点(℃):<-50
引燃温度(℃):472
爆炸上限%(V/V):16.0
爆炸下限%(V/V):3.0
溶解性:不溶于水,微溶于乙醇、丙酮,溶于苯,与四氯化碳互溶。
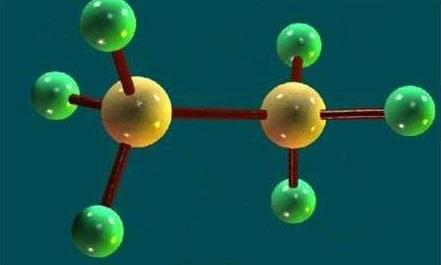
乙烷的交叉式构象
乙烷的C-C单键可以自由旋转,如果乙烷中的一个C原子不动,另一个绕C-C单键自由旋转,则一个C原子上的3个H相对于另一个C原子上的3个H可以有无数的空间排列。这种由于单键旋转而产生的分子中的原子或基团在空间的不同排列形式叫做构象,每一个个构象就叫做一个构象异构体,由于C-C单键自由旋转,乙烷可以有无数种构象,乙烷的优势构象是交叉式。这个时候2个C原子上的H距离最远相互间的排斥力最小,因而分子内能最低 也最稳定。内能最高的是重叠式,这时2个C上的H两两相对,相互间的排斥力,内能最高,最不稳定,其他的构象内能介于这两者之间。在旋转过程中,由于两个甲基上的氢原子的相对位置不断发生变化,这就形成了许多不同的空间排列方式。其中一种是一个甲基的氢原子正好处在另一个甲基的两个氢原子之间的中线上。这种排布方式叫做交叉式构像。
另一种是两个碳原子上的各个氢原子正好处在相互对映的位置上。这种排布方式叫重叠构像。交叉式和重叠式是乙烷无数构像中的两种极端情况。
乙烷单键的旋转也并不是完全自由的。可以把这个能垒看作是克服氢原子的斥力,以及很可能还有由于碳氢原键电子云之间的斥力所需要的能量。重叠式由于前后两个氢原子相距最近,以及碳氢键间8电子云斥力,所以能量最高,交叉式中C-H相距最远,斥力最小,能量最低,是乙烷最有利的构像。
欢迎您浏览更多关于乙烷的相关新闻资讯信息



