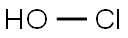-
性質
次亜塩素酸は強力な酸化剤であり、漂白や殺菌などに使用されます。次亜塩素酸としては不安定なため、ナトリウム塩であるなどの化合物として用いられます。
なお、コロナウイルス感染対策として注目を集めた「次亜塩素酸水」は、次亜塩素酸を主成分とした電解水であり、やを水に溶かして電気分解して得られる水溶液です。
-
反応
次亜塩素酸は、水溶液中では部分的にアニオン次亜塩素酸ClO−に解離します (HClO⇌ClO−+H+)。次亜塩素酸は、HClと反応して塩素を形成し (HClO+HCl→H2O+Cl2)、アンモニアと反応してモノクロラミンを (NH3+HClO→ NH2Cl+H2O)、また有機アミンと反応してN-クロロアミンを形成することもあります。過酸化水素水と反応させる場合には、酸素が生じます (HClO+H2O2→HCl+H2O+O2)。さらに次亜塩素酸は、DNA、RNA、脂肪酸基、コレステロール、タンパク質など、さまざまな生体分子とも反応します。
-
解説
次亜塩素酸,化学式 HClO 。遊離の状態では存在せず,水溶液中でだけ安定である。-20℃では数日間保存が可能である。徐々に分解して塩素,酸素および過塩素酸を生じる。酢酸よりも弱い酸であるが,強力な酸化剤で,ナトリウム塩は酸化漂白剤として重要である。
ブリタニカ国際大百科事典 小項目事典 ブリタニカ
-
用途
不安定な物質であり、水溶液中で徐々に分解する。次亜塩素酸および次亜塩素酸の塩類は酸化剤、漂白剤、外用殺菌剤、消毒剤として利用される。
-
製法
塩素に水が作用すると生成する次亜塩素酸。
-
説明
Hypochlorous acid [7790-92-3], HOCl, Mr 52.5, is only moderately stable in aqueous solution. It is colorless when dilute and yellowish at higher concentrations. Hypochlorous acid is one of the most powerful oxidizing agents known. Hypochlorous acid solution decomposes exothermically. The main decomposition products are hydrochloric acid and oxygen.
-
化学的特性
Greenish-yellow aqueous solution.
Highly unstable, weak acid. Decomposes to hydrogen chloride and oxygen. Can exist only in dilute
solutions.
-
物理的性質
Greenish-yellow aqueous solution; unstable; weak acid, pKa7.40 at 25°C;soluble in water.
-
使用
Disinfectant. Because of its instability, hypochlorous acid is not used extensively as an oxidizing or bleaching agent. It was used mainly in the water treatment industry for slime control, for treatment of drinking water, and for sterilization of swimming pools. These applications have now been taken over by the more stable hypochlorites.
-
定義
ChEBI: Hypochlorous acid is a chlorine oxoacid with formula HOCl; a weak, unstable acid, it is the active form of chlorine in water. It has a role as a human metabolite, an EC 3.1.1.7 (acetylcholinesterase) inhibitor and an EC 2.5.1.18 (glutathione transferase) inhibitor. It is a member of reactive oxygen species and a chlorine oxoacid. It is a conjugate acid of a hypochlorite.
-
製造方法
Hypochlorous acid is obtained by dissolving chlorine in water, or by addingbleaching powder or sodium hypochlorite to water. A better method of pro-duction is passing chlorine gas into a well-agitated suspension of mercuricoxide:
2Cl2 + 2HgO + H2O → HgO•HgCl2 + 2HOCl
or by distilling chlorine hexahydrate and mercuric oxide at low pressure:
2Cl2•6H2O + HgO → 2HOCl + HgCl2 + 5H2O
The latter process can yield a 25% acid solution.
Hypochlorous acid also may be obtained by hydrolysis of chlorine monoflu-oride:
ClF + H2O → H+ + F¯ + HOCl
The above reaction may be explosive and is not recommended for preparinghypochlorous acid.
-
危険性
Irritant to skin and eyes.
-
使用用途
次亜塩素酸を主成分とした電解水である「次亜塩素酸水」は、殺菌消毒剤として野菜や食器、施設等の消毒に使われています。
次亜塩素酸は、消毒用途において液体スプレー、ウェットワイプ、エアロゾルなどの形で使用されてきました。次亜塩素酸水は、消毒室の霧やエアロゾル化用途に適しており、オフィス、病院、診療所などの屋内環境の消毒に適していることが研究により示されています。
またナトリウム塩である「次亜塩素酸ナトリウム」は物質を漂白する性質があり、パルプの漂白や、身近なところでは、塩素系漂白剤としてキッチン用漂白剤等に使用されています。
-
取扱いおよび保管上の注意
取扱い及び保管上の注意は、下記の通りです。
- 保管容器は、換気の良い冷暗所で保管する。
- 常温保存中も微量が分解され、アルカリ性に移行してしまうため、早めに使用する。
- 日光、特に紫外線の照射や有機物との接触により急速に分解するため、保管場所の環境に注意する。
- 塩素ガスを発生するため、酸との接触は避ける。
- 屋外や換気の良い区域のみで使用する。
- 使用時は保護手袋、保護眼鏡を着用する。
- 取扱い後はよく手を洗浄する。
- 皮膚に付着した場合は、石鹸と水で洗い流す。
- 眼に入った場合は、水で数分間注意深く洗う。
参考文献
-
法規情報
次亜塩素酸は、毒物及び劇物取締法や消防法、化学物質排出把握管理促進法 (PRTR法)、労働安全衛生法などのいずれの法令にも指定はありません。
-
参考文献
C.M. Gerritsen, D.W. Margerum, Inorg. Chem., 29, 2757 (1990), DOI: 10.1021/ic00340a010.