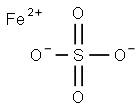-
定義
本品は、硫酸(*)の第一鉄塩であり、次の化学式で表される。
参照表示名称:硫酸
-
性質
硫酸鉄の見た目は薄い青緑色で、結晶状または結晶性粉末の固体です。水には溶けやすく、無水和物は20°Cの水100gに26.6g溶解します。ただし、にはほとんど溶けません。水溶液は緑色で、徐々に酸化します。アルカリ性溶液やエタノール溶液中では、酸化が加速されます。
硫酸鉄は被酸化性を有する物質です。被酸化性とは、酸化性の物質によって酸化される可能性がある性質のことです。
-
解説
硫酸鉄(Ⅱ) 無水和物FeSO4、式量151.92(硫酸第一鉄ともいう)のほか一、四、五、七水和物がある。このうち一、五、七水和物は天然にも存在する。七水和物は緑礬(りょくばん)melanteriteともよばれ、もっとも重要なものである。鉄を希硫酸に溶解するか、水で湿らせた黄鉄鉱FeS2を空気酸化することによって得られる水溶液を、56℃以下で結晶化すると七水和物が得られる。56℃以上では四水和物が、64℃以上では一水和物が晶出する。この水溶液を過剰の硫酸とともに真空中で蒸発濃縮すれば五水和物が得られる。無水和物は淡緑色の結晶で、湿った空気中に放置すると七水和物となる。無水和物は20℃の水100グラムに26.6グラム溶ける。七水和物は緑色の結晶で、空気中に放置すると酸化されて赤褐色の塩基性硫酸鉄(Ⅲ)に変わる。水溶液は緑色で、きわめてゆっくりと酸化されるが、アルカリ性溶液、エタノール(エチルアルコール)溶液中では加速される。一酸化窒素と不安定な褐色の化合物をつくるので硝酸イオンや亜硝酸イオンの検出に利用される。べんがら、黒色インキ、顔料(プルシアンブルー、鉄黒(てつぐろ))の製造、還元剤、媒染剤、防腐剤などに用いられる。
-
用途
強化剤、製造用剤
-
構造
無水和物の硫酸鉄の式量は151.92であり、1、4、5、7水和物もあります。天然には1、5、7水和物が存在します。特に7水和物は緑礬 (英: melanterite) と呼ばれ、化学式はFeSO4・7H2Oです。無水和物が湿った空気に触れると、7水和物に変わります。
-
合成法
1. 硫酸鉄 (II) の合成法
と鉄の反応によって水素が生じ、硫酸鉄が得られます。水で湿った黄鉄鉱 (FeS2) を空気酸化して得た水溶液を、56°C以下で結晶化すると7水和物を生成可能です。
56°C以上の場合には4水和物が晶出し、64°C以上では1水和物が生じます。過剰の硫酸を加えてこの水溶液を真空中で蒸発濃縮すると、5水和物が得られます。
2. 硫酸鉄 (III) の合成法
硫酸鉄には硫酸鉄 (II) 以外にも、硫酸鉄 (III) が存在します。硫酸第二鉄とも呼ばれ、無水和物の硫酸鉄 (III) の化学式はFe2(SO4)3で、式量は399.9です。硫酸鉄 (III) には3、6、7、7.5、9、10、12水和物があり、7、7.5、9、10、12水和物は自然界にも存在します。
硫酸鉄 (II) 水溶液を酸化して、蒸発濃縮すると、硫酸鉄 (III) の水和物の結晶を生成可能です。ただし、結晶化の条件によって、結晶水の数が違います。水和物の加熱と脱水では、白色または淡黄色の粉末である硫酸鉄 (III) 無水和物が得られます。
-
説明
Green vitriol, FeSO4.7H20, has been known since the thirteenth
century ; it crystallizes from solutions of iron or iron bases in dilute sulphuric acid. The
heptahydrate forms green monoclinic crystals of density 1·88, very soluble in water (296 g
litre-1 FeS04 at 25°C). By precipitating the aqueous solution with ethanol, heating the
heptahydrate to 140° in vacuo or by crystallizing it from 50 % sulphuric acid, the white monohydrate
is obtained. This can be further dehydrated to the white, amorphous FeSO4 by
heating to 300° in a current of hydrogen. At red heat the sulphate decomposes :
2FeS04 -> Fe203+S02+S03
A tetrahydrate, FeS04.4H20, crystallizes from aqueous solutions above 56°.
-
化学的特性
Ferrous sulfate is a greenish or yellowish solid
in fine or lumpy crystals.
-
物理的性質
White orthorhombic crystal; hygroscopic; density 3.65 g/cm3; soluble in water (26.6g/100g water at 20°C). The monohydrate is a yellowish-white monoclinic crystal; density 3.0 g/cm3; decomposes at 300°C; soluble in water. Heptahydrate is bluish-green monoclinic crystal; refractive index 1.47; hardness 2 Mohs; density 1.89g/cm上3; decomposes at about 60°C; very soluble in water; soluble in absolute methanol; slightly soluble in ethanol.
-
天然物の起源
Iron(II) sulfate is probably the most important salt of iron, as well as the longest-known iron(II) compound. The compound is used as a mordant in dyeing; as a component of writing ink; in electroplating baths; in radiation dosimeters; in lithography and engraving; as a weed-killer; and in water purification. A major application of this compound is in the manufacture of other iron(II) salts including Prussian blue or ferric ferrocyanide. Iron(II) sulfate also is used as a reducing agent and an analytical reagent (in brown ring test for nitrate).
-
使用
Ferrous Sulfate is a nutrient and dietary supplement that is a source
of iron. it is a white to grayish odorless powder. ferrous sulfate hep-
tahydrate contains approximately 20% iron, while ferrous sulfate
dried contains approximately 32% iron. it dissolves slowly in water
and has high bioavailability. it can cause discoloration and rancidity.
it is used for fortification of baking mixes. in the encapsulated form
it does not react with lipids in cereal flours. it is used in infant foods,
cereals, and pasta products.
-
調製方法
Iron(II) sulfate in industrial scale is mostly produced in the pickling process as a by-product of the steel industry. It is obtained when the surface of steel is cleaned with dilute sulfuric acid to remove metal impurities. In the laboratory iron(II) sulfate heptahydrate may be prepared by dissolving iron in dilute sulfuric acid in a reducing atmosphere, followed by crystallization:
Fe + H2SO4 → FeSO4 + H2
Alcohol may be added to the aqueous solution to speed up crystallization; iron(II) may otherwise oxidize to iron(III) during a slow crystallization process.
Iron(II) oxide or carbonate may be used instead of iron metal to prepare the heptahydrate.
.
-
定義
A rusty-brown solid prepared by the action
of heat on iron(III) hydroxide or iron(II)
sulfate. It occurs in nature as the mineral
hematite. Industrially it is obtained by
roasting iron pyrites. Iron(III) oxide dissolves
in dilute acids to produce solutions
of iron(III) salts. It is stable at red heat, decomposes
around 1300°C to give triiron
tetroxide, and can be reduced to iron by
hydrogen at 1000°C. Iron(III) oxide is not
ionic in character but has a structure similar
to that of aluminum(III) oxide.
-
危険性
Ingestion causes intestinal disorders.
-
使用用途
硫酸鉄は食品添加物の1つとして、果物や野菜の発色や変色の防止に使用可能です。さらに、鉄分を補給する栄養強化剤として、サプリメントや栄養ドリンクなどにも含まれています。
また、鉄分は植物の生育に必要な微量元素の1つです。植物の生育時に鉄分を補給する目的で肥料に添加され、葉面散布用の溶液の原料に利用されます。ほかにも、化学酸化法 (フェントン法) を用いた排水処理施設用の薬品として、凝集処理時に使用可能です。
硫酸鉄は一酸化窒素と反応し、不安定な褐色の化合物を作ります。そのため、亜硝酸イオンや硝酸イオンの検出に利用可能です。
-
农业用途
Copperas, also called green vitriol, is ferrous sulphate heptahydrate. It is an iron salt fertilizer, which is most effective in overcoming iron deficiency.
-
安全性プロファイル
A human poison by
ingestion. Moderately toxic to humans by an
unspecified route. An experimental poison
by ingestion, intraduodenal, intraperitoneal,
intravenous, and subcutaneous routes.
Human systemic effects by ingestion:
aggression, somnolence, brain recorlng
changes, diarrhea, nausea or vomiting,
bleedmg from the stomach, coma.
Questionable carcinogen with experimental
tumorigenic data. Experimental teratogenic
and reproductive effects. Mutation data
reported. Potentially explosive reaction with
methyl isocyanoacetate at 25'. May igmte on
contact with arsenic trioxide + sodium
nitrate. When heated to decomposition it
emits toxic fumes of SOx. See also IRON COMPOUNDS.
-
職業ばく露
It is used as a fertilizer, food or feed
additive; and in herbicides; process engraving; dyeing, and
water treatment. A byproduct of various chemical and
metal treating operations.
-
概要
硫酸鉄とは、化学式がFeSO4で表される無機化合物です。
硫酸鉄 (II) や硫酸第一鉄とも呼ばれます。不燃性ですが、加熱によって腐食性を示し、有毒な煙霧や蒸気が発生する恐れがあります。
硫酸鉄はべんがら、黒色インキ、顔料の製造に用いられ、磁性材料、還元剤、浄水剤、媒染剤、消毒剤、防腐剤として使用可能です。食品添加物に認められており、硫酸鉄 (II) を食品に用いた際には、「硫酸鉄」や「硫酸第一鉄」と記載されます。
-
不和合性
Aqueous solution is acidic. Contact with
alkalies form iron. Keep away from alkalies, soluble carbo nates; gold and silver salts; lead acetate; lime water, potassium
iodide; potassium and sodium tartrate; sodium borate; tannin.