-
性質
物理的性質
見た目は白色または無色で、結晶状もしくは結晶性粉末の固体です。過剰の水酸化アルカリには水酸化鉛イオンとなって溶けますが、水への溶解度は25℃において0.0425g/1Lとほとんど溶けません。また、やアセトンなどの有機溶媒にも難溶です。
結晶構造は、硫酸バリウム型構造のものが安定であり直方晶系の構造をしています。融点は1,170℃ですが、およそ1,000℃付近から分解が始まり、二酸化硫黄および三酸化硫黄を発生しながら酸化鉛(II)あるいは四酸化三鉛に分解されます。
-
解説
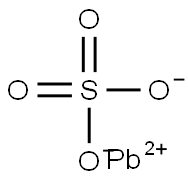
硫酸鉛とは、化学式PbSO4で表される硫酸イオンと鉛イオンが結合した無機物です。
物質量は303.26g/mol、密度は6.29 g/cm3、密度は1170℃です。常温常圧では、白色の固体の外見をしています。
-
用途
ペイント顔料,釉薬,触媒,樹脂安定剤
-
製法
硫酸鉛は、加熱を伴いながらと硝酸鉛、または硫酸と酢酸鉛など、強酸と水溶性の鉛化物を反応させて生成されます。このとき、白色の沈殿として硫酸鉛が得られます。
また、鉛蓄電池の活物質としては酸化鉛(II)に希硫酸を加えて作ったペースト状のものが用いられますが、これはPbSO4·PbO、PbSO4·2PbO、PbSO4·3PbO、PbSO4·4PbOのような組成の各種塩基性塩が含まれています。さらに、この反応において水が副生成物です。
硫酸と鉛を反応させると硫酸鉛と水素が生成されますが、反応物の表面に難溶性塩の被膜がつくられることから、加熱して反応を進みやすくする必要があります。
-
危険性
硫酸鉛は毒性が高く、発がんの恐れや妊婦の場合には胎児への悪影響、臓器の障害 (腎臓、神経系、消化器系、血液系) を持っています。そのため、取り扱う際には手をよく洗ったりゴム手袋や白衣、マスク、保護メガネの着用を行う必要があります。
さらに、水中の生物にも多大な悪影響を与えるため、水中への放出は厳しく制限がされています。
-
主な用途/役割
無機塩。軟質用。
-
化学的特性
white crystals or powder
-
使用
Lead(II) sulfate is used in pigments, galvanic batteries, lithography, weighting fabrics. It is also used as intermediates.
-
調製方法
Lead sulfate, PbSO4, is soluble in concentrated acids and alkalies, forming hydroxyplumbites. It is prepared by treating lead oxide, hydroxide, or carbonate with warm sulfuric acid, or by treating a soluble lead salt with sulfuric acid.
-
定義
anglesite: A mineral form oflead(II) sulphate, PbSO4.
-
一般的な説明
A white crystalline solid. Insoluble in water and sinks in water. Contact may irritate skin, eyes, and mucous membranes. May be mildly toxic by ingestion, inhalation and skin absorption. Used to make other chemicals. Use: in lithography, battery acid solution treated fabrics, used in varnishes.
-
空気と水の反応
Insoluble in water.
-
反応プロフィール
LEAD(II) SULFATE reacts explosively with boric acid [Bretherick 1979. p. 1029]. Special Hazards of Combustion Products: Toxic metal fumes [USCG, 1999].
-
健康ハザード
INHALATION: Joint and muscle pains, headache, dizziness and insomnia. Weakness, frequently of extensor muscles of hand and wrist (unilateral or bilateral). Heavy contamination. Brain damage. Stupor progressing to coma - with or without convulsion, often death. Excitation, confusion, and mania less common. Cerebrospinal pressure may be increased. EYES: Caused a moderat purulent reaction and general inflammation of the rabbit eye. INGESTION: Abdominal pain, diarrhea, constipation, loss of appetite, muscular weakness, headache, blue line on gums, metallic taste, nausea and vomiting.
-
火災危険
Special Hazards of Combustion Products: Toxic metal fumes
-
使用用途
1. 鉛蓄電池
硫酸鉛は、の電極材料となる正極および負極活物質として用いられています。電極材料となる鉛が比較的安価であることから、コストパフォーマンスの高いを製造することができます。正極では二酸化鉛が、負極では鉛が電極として用いられており、どちらでも硫酸が電解液として使用されてきました。
希硫酸は水によりSO₄²⁻とH⁺に電離しており、負極では鉛が酸化されて生じた鉛イオンと硫酸イオンが反応して硫酸鉛PbSO₄を生成します。この硫酸鉛は負極表面に固体になって付着していくため、負極の質量はどんどん増加していきます。また、鉛が酸化されることで発生した電子は、導線を通って正極に送られます。
さらに、電解液中には水素イオンも放出され、水素イオンは自由電子が集まった正極に向かい、電解液中を移動することが電池の原理です。一方、正極板では負極からやって来た自由電子および水素イオンを受け入れて、二酸化鉛と希硫酸とで化学反応を起こします。その結果硫酸鉛と水が生成し、負極板と同じように硫酸鉛は正極板に付着していきます。
また、放電によって両極板の表面に付着した硫酸鉛などを利用して充電反応を起こすことで、放電する前の状態に戻して電池を繰り返し使用できるようにします。充電により正極は酸化されに、負極はされ単体の鉛となることが鉛蓄電池の性質です。
2. 顔料
硫酸鉛は、白色を示すことから古代より白色の顔料としてさまざまな場面で用いられてきました。奈良にある正倉院の宝物からも硫酸鉛が用いられている物品が発見されています。
また、硫酸鉛は、黄鉛やモリブデートオレンジのような着色顔料の原材料の1つとしても使用されることが特徴です。
3. その他
その他の用途として、釉薬、触媒、樹脂安定剤などが挙げられます。
-
職業ばく露
Lead sulfate is used in storage batteries and paint pigments. Used in the making of alloys, fastdrying oil varnishes; weighting fabrics; in lithography
-
輸送方法
UN2291 Lead compounds, soluble n.o.s., Hazard
Class: 6.1; Labels: 6.1-Poisonous materials, Technical
Name Required. UN1794 Lead sulfate with more than 3%
free acid, Hazard class: 8; Labels: 8-Corrosive material.
UN3077 Environmentally hazardous substances, solid, n.o.
s., Hazard class: 9; Labels: 9-Miscellaneous hazardous
material, Technical Name Required
-
不和合性
Incompatible with oxidizers (chlorates,
nitrates, peroxides, permanganates, perchlorates, chlorine,
bromine, fluorine, etc.); contact may cause fires or explosions. Contact with potassium can cause explosion. Keep
away from alkaline materials, strong bases, strong acids,
oxoacids, and epoxides