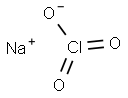-
外観
無色澄明の液体
-
性質
塩素酸ナトリウムは、きわめて水に溶けやすいです。水溶液は中性で、強酸と反応すると二酸化塩素を放出します。
光で分解するため、褐色の瓶に密栓して保管するか、冷暗所に保管する必要があります。
融点は248℃です。酸性溶液中では強い酸化剤となり、300℃以上で酸素を放って分解します。有機物、金属粉、硫黄が混じると、加熱や摩擦衝撃などで爆発します。
-
溶解性
水に易溶101g/100g水, 20℃)。水に溶けやすく、エタノールにやや溶けにくい。
-
解説
塩素酸ナトリウムとは、のナトリウム塩です。
塩素酸ソーダとも呼ばれています。潮解性がある無色の結晶です。有機物のような可燃性物質が混入することで、爆発する恐れがあります。
また、消防法では「第1類危険物」に、毒劇物取締法では「劇物」「発火性または爆発物のある劇物」に、労働安全衛生法では「危険物・酸化性の物」に、それぞれ指定されており、取り扱いには注意が必要です。
-
用途
農薬、分析用試薬、酸化剤、クラフトパルプ、漂白剤の原料
-
構造
塩素酸ナトリウムは無色無臭の結晶です。化学式はNaClO3、モル質量は106.44で、密度は2.5です。構造は+5価の塩素原子が3個の酸素原子を持った形を取っています。
-
合成法
塩素酸ナトリウムは、の熱溶液にを吹き込んで酸化することによって生成します。工業的に主流の方法は、塩化ナトリウム飽和溶液の電気分解です。
ただし、電気分解の際に、食塩水電解用の寸法安定性電極のほか、耐酸化性のある白金、黒鉛、二酸化鉛などが陽極に必要です。pHや温度も重要で、高pHや低温条件では (NaClO) が生成します。
実験室では、次亜塩素酸ナトリウム (NaClO) の不均化でも、塩素酸ナトリウムが得られます。ナトリウム塩とさらし粉を反応させ、加熱することによって生成可能です。いずれの反応においても、収率には水溶液のpHが大きく影響を与えます。
-
化学的特性
Sodium chlorate, NaCI03, is colorless,odorless crystals with a cooling, saline taste, is soluble in water and alcohol,but must not be triturated with any combustible substance. Derived by heating and electrolyzing a concentrated acid solution of sodium chloride so that the chlorate is crystallized out. Sodium chlorate is a nonselective soil sterilant used on noncrop land or in combination with triazines, ureas, or other organic herbicides for soil sterilization. It leaches,has foliar contact activity, and in the past, was used widely along railroads. It is flammable when dried on foliage, and many railroad fires occurred when sparks from coal-fired engines landed on sprayed plants. Sodium chloride (table salt) is an example of an herbicide that desiccates and disrupts a plant's osmotic balance. It has been used for nonselective weed control for centuries.
-
使用
Sodium chlorate is used to prepare chlorine dioxide in the pulp and paper industry. It is utilized for bleaching the wood pulp in order to make environmentally friendly and quality white paper products. It is also used to produce other perchlorate compounds in the industry.
-
定義
ChEBI: Sodium chlorate is an inorganic sodium salt that has chlorate as the counter-ion. An oxidising agent, it is used for bleaching paper and as a herbicide. It is also used in the manufacture of dyes, explosives and matches. It has a role as a herbicide. It is an inorganic sodium salt and a chlorate salt.
-
一般的な説明
Sodium chlorate in a water solution is a clear colorless liquid. Sodium chlorate is noncombustible but Sodium chlorate can accelerate the burning of surrounding combustible materials. This can easily occur if the material should dry out. Contact with strong sulfuric acid may cause fires or explosions.
-
空気と水の反応
Soluble in water.
-
反応プロフィール
SODIUM CHLORATE decomposes upon heating forming O2; reacts with strong acids forming toxic and explosive ClO2; reacts with many substances [Handling Chemicals Safely 1980 p. 833]; metal chlorates are oxidants in the presence of strong acid; liberates explosive chlorine dioxide gas; heating a moist metal chlorate and a dibasic organic acid liberates chlorine dioxide and carbon dioxide; mixtures of perchlorates with sulfur or phosphorus are explosives [Bretherick 1979 p. 100]; mixtures of the chlorate with ammonium salts(ammonium thiosulfate), powdered metals, silicon, sulfur, or sulfides are readily ignited and potentially explosive [Bretherick 1979 p. 806]. A combination of finely divided aluminum with finely divided bromates(also chlorates and iodates) of barium, calcium, magnesium, potassium, sodium or zinc can explode by heat, percussion, and friction [Mellor 2:310 1946-47]. Sodium chlorate and arsenic trioxide form a spontaneously flammable mixture [Ellern 1968 p. 51]. Mixtures of organic material and more than 10% sodium chlorate are sufficiently combustible to be hazardous at low relative humidity. Mixtures of organic material such as charcoal, sugar, flour, or shellac and sodium chlorate may be ignited by friction or shock [Chem. Safety Data Sheet SD-42 1951].
-
危険性
Dangerous fire risk, strong oxidant, contact
with organic materials may cause fire.
-
健康ハザード
Contact causes irritation of eyes and skin. INGESTION: May cause nausea, vomiting, diarrhea, abdominal or gastric pain, dyspnea and other symptoms. The major cause of death from a lethal dose is acute renal failure.
-
関連化合物
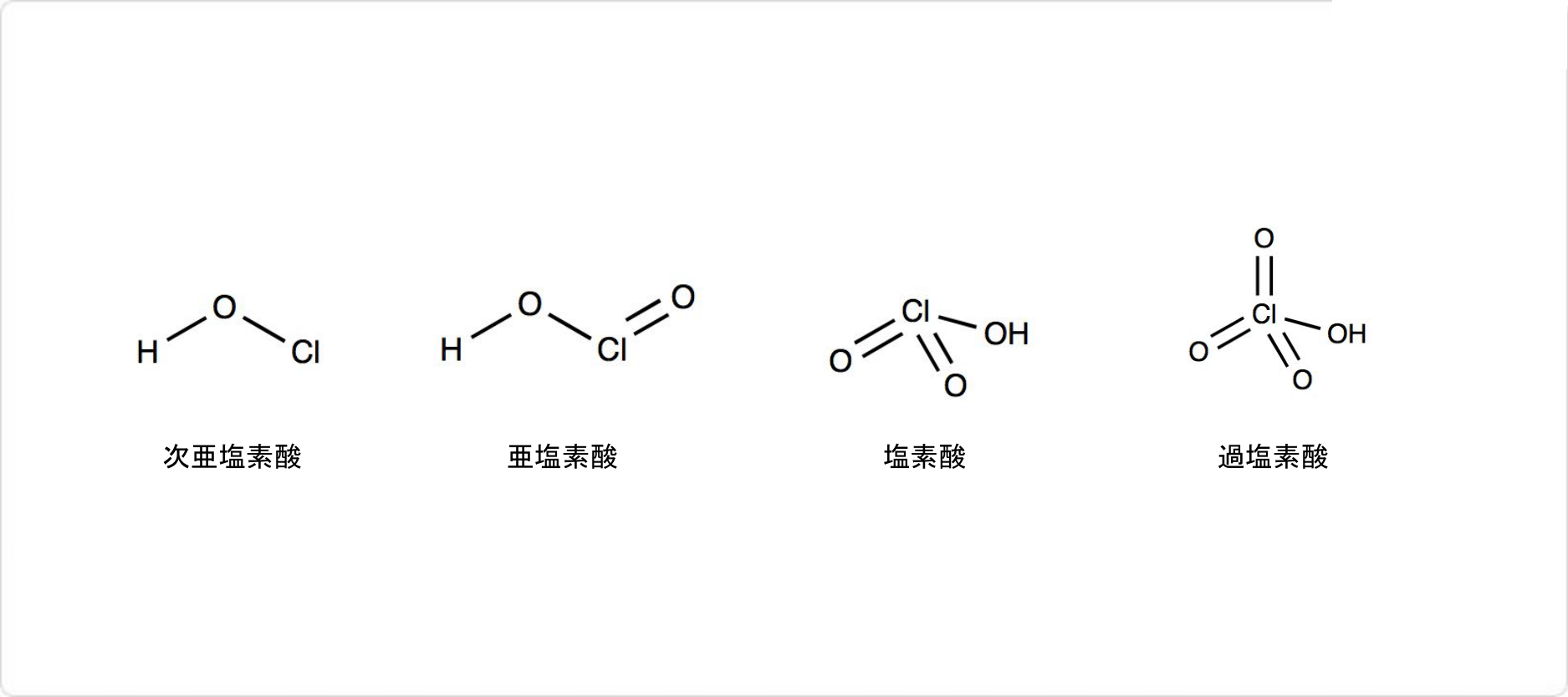
塩素酸ナトリウムの関連化合物の構造
塩素のオキソ酸には塩素酸以外にも、、亜塩素酸、過塩素酸があります。そのため、塩素酸塩だけでなく、次亜塩素酸塩や亜塩素酸塩、過塩素酸塩が存在します。
次亜塩素酸の化学式はHClOであり、塩素の酸化数は+1です。酸素原子に水素原子と塩素原子が結合した構造を取っています。亜塩素酸の化学式はHClO2であり、塩素の酸化数は+3です。
塩素原子がヒドロキシ基と酸素原子が1つずつ持っています。過塩素酸の化学式はHClO4であり、塩素の酸化数は+7です。1個のヒドロキシ基と3個のオキソ基が塩素原子に結びついた構造を取っています。
参考文献
-
使用用途
塩素酸ナトリウムは、重要な工業薬品であり、・亜塩素酸塩・過塩素酸塩の製造原料として用いられています。二酸化塩素はパルプの漂白剤として、は繊維漂白剤として利用可能です。
また、単体でも優れた非選択性除草剤として利用されています。さらに、酸化剤として、染色やなどの他、ウラン鉱からの酸性浸出にも用いられています。
その他にも、塩素酸ナトリウムは、「マッチ」「花火」「爆薬」「殺虫剤」「印刷インキ」「染料」「化粧品原料」「織物加工」「製紙」「皮なめし」などに使用可能です。
-
化学性质
酸化性固体,482℃以上で酸素を放出し支燃性を示す
-
製品名
ASEX®; ATLACIDE[C]; ATRATOL B-HERBATOX®[C]; BAREGROUND®; BEST MAGCHLOR DEFOLIANT®; CHAPMAN WEED FREE®; CHLORAX®; D-LEAF COTTON DEFOLIANT®; DE-FOL-ATE®; DESOLET®; DREXEL DEFOL®; DROP LEAF®; EVAU-SUPERFALL®; FALL®; GRAIN SORGHUM HARVEST AID®; GRANEX OK®; HARVEST-AID®; KLOREX®; KM SODIUM CHLORATE®; KUSA-TOHRUKUSATOL®; LOREX®; ORTHO C-1 DEFOLIANT & WEED KILLER®; OXYCIL®; RASIKAL®; SHED-A-LEAF®; TRAVEX®; TUMBLEAF®; 20 MULE TEAM HIBOR®[C]; UNITED CHEMICAL DEFOLIANT NO.1®; VAL-DROP®
-
安全性プロファイル
Human poison by unspecified routes. Moderately toxic experimentally by ingestion and intraperitoneal routes. Human systemic effects by ingestion: blood hemolysis with or without anemia, methemoglobinemiacarboxyhemoglobinemia and pulmonary changes. Mutation data reported. A skin, mucous membrane, and eye irritant. Damages the red blood cells of humans when ingested. A powerful oxidizer. It can explode on contact with flame or sparks (static discharge) and has caused many industrial explosions. May react explosively with agricultural materials (e.g., peat, powdered sulfur, sawdust, urotropine, thiuram), alkenes + potassium osmate, aluminum + rubber, ammonium salts, grease, leather, powdered metals, nonmetals, sulfides, cyanides, cyanoborane oligomer, nitrobenzene, organic matter, paint + polyethylene, phosphorus, sodium phosphinate. Violent reaction or ignition with aluminum, ammonium sulfate, Sb2S3, arsenic, arsenic trioxide, 1,3bis(trichloromethy1benzene) + heat, carbon, charcoal, MnOr, phosphorus, potassium cyanide, osmium + heat, paper, sulfuric acid, thiocyanates, triethylene glycol + wood, wood, zinc. Can also react violently with nitrobenzene, paper, metal sulfides, dibasic organic acids, organic matter. When heated to decomposition it emits toxic fumes of Cland Na2O. See also CHLORATES.
-
職業ばく露
Sodium chlorate is used to manufacture dyes, explosives, in paper pulp processing and as a weed killer; used as a constituent of atratol and pramitol.
-
特徴
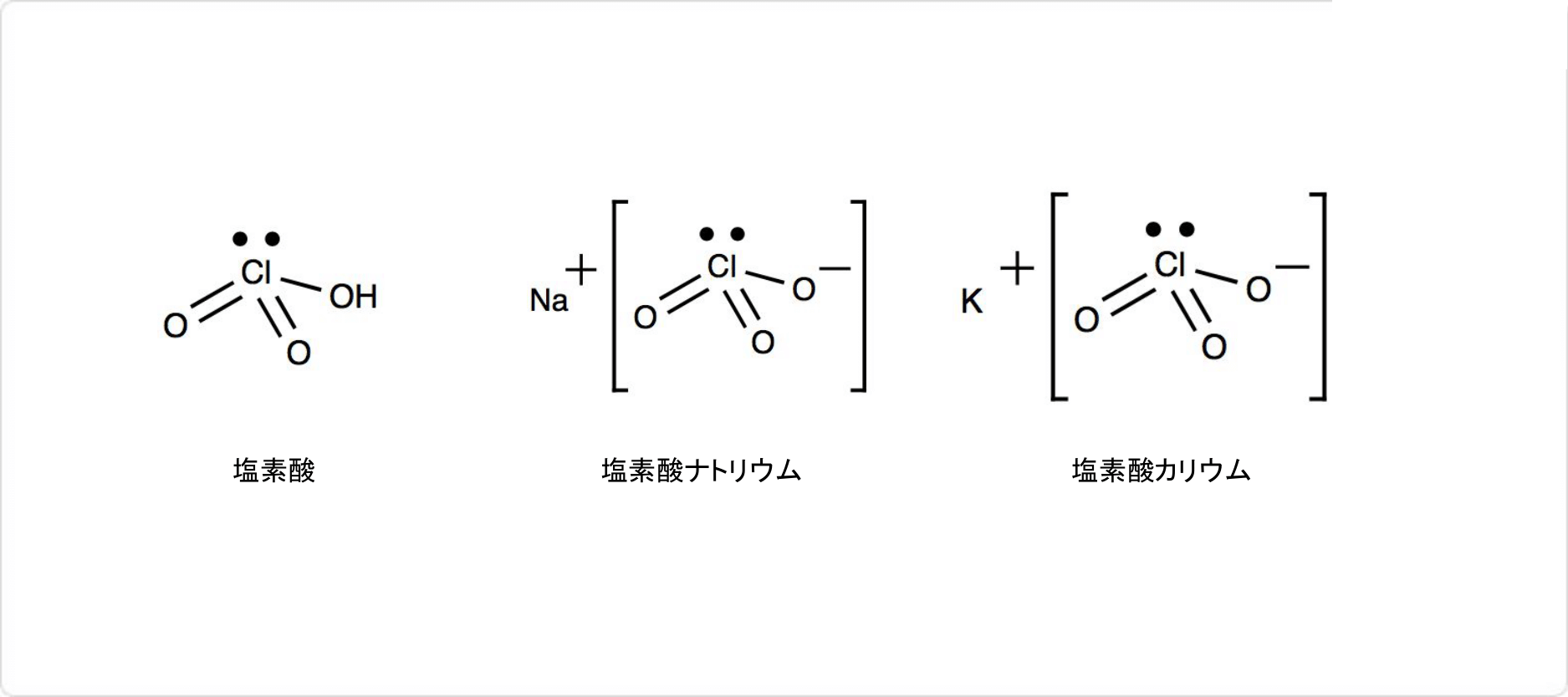
塩素酸塩の構造
塩素酸ナトリウムは、ナトリウムと塩素酸 (英: chloric acid) の塩です。塩素酸とは、塩素のオキソ酸の1種であり、化学式はHClO3です。
塩素酸の塩には塩素酸ナトリウム以外にも、 (英: potassium chlorate) などがよく知られています。塩素酸カリウムの化学式はKClO3です。
-
合成方法
塩素酸ナトリウム水溶液を白金または二酸化鉛電極上で電解酸化する
-
輸送方法
UN1495 Sodium chlorate, Hazard Class: 5.1; Labels: 5.1-Oxidizer. UN2428 Sodium chlorate, aqueous solution, Hazard Class: 5.1; Labels: 5.1-Oxidizer.
-
純化方法
It is crystallised from hot water (0.5mL/g). It is a strong oxidising agent, and should be kept clear from organic matter.
-
不和合性
A strong oxidizer. Potentially explosive. Reacts violently with combustibles, sulfuric acid; and reducing materials. Reacts with strong acids giving off carbon dioxide. Explosions may be caused by contact with ammonia salts; ammonium thiosulfate; antimony sulfide; arsenic, carbon, charcoal, organic matter; organic acids; thiocyanates, chemically active metals; oils, metal sulfides; nitrobenzene, powdered metals; sugar. Reacts with some organic contaminants forming shock-sensitive mixtures. Decomposes on heating above 300�C or on burning, producing oxygen and toxic chlorine fumes. Attacks zinc, magnesium, and steel.
-
廃棄物の処理
In accordance with 40CFR 165 recommendations for the disposal of pesticides and pesticide containers. Must be disposed properly by following package label directions or by contacting your local or federal environmental control agency, or by contacting your regional EPA office.