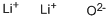-
外観
白色, 結晶~粉末
-
種類
酸化リチウムは、一般的には主に研究開発用試薬製品として販売されています。容量の種類には、5g、10g、25g、100g、500gなどがあり、実験室で取り扱いやすい容量での提供が一般的です。
水との反応性が高く吸湿性も高い物質ではありますが、適切な保管環境においては安定であり、通常は室温で保管可能な試薬製品として扱われています。アルゴンを封入した状態で販売されている場合もあります。
-
性質
酸化リチウムは、リチウムイオンLi+と酸化物イオンO2−からなるイオン結晶です。密度は2.013g/mLであり、水と反応して (発熱反応) 水酸化リチウムを生成します。酸化リチウムは、他のアルカリ金属酸化物よりも熱力学的に安定な物質です。
結晶構造は、立方晶系の逆蛍石型構造を取ります。この構造は、酸化カリウムおよび酸化ナトリウムと同様のものです。リチウムイオンLi+は正四面体4配位、酸化物イオンO2−は立方体8配位となっており、格子定数はa = 4.61Åです。
-
解説
Li2O(29.88).リチウムの炭酸塩,水酸化物,硝酸塩を水素気流中で800 ℃ に加熱して得られる.白色の多孔性粉末.融点1570 ℃.密度2.013 g cm-3.空気中で水や二酸化炭素を吸収する.水に溶けて水酸化リチウムを生じる.導電性ガラス,電池,固体電解質の製造に用いられる.[CAS 12057-24-8]
森北出版「化学辞典(第2版)
-
合成
酸化リチウムは、金属リチウムを空気中または酸素中で燃焼させることによって合成可能です。本反応のような酸素との反応では、過酸化リチウムLi2O2および超酸化リチウムLiO2は生成しません。
その他の方法では、銀箔に包んだ無水水酸化リチウムをニッケルボート中で減圧下675℃に加熱することで分解生成物として合成したり、炭酸リチウム (700℃で50時間減圧下で加熱) や、無水過酸化リチウム (ヘリウム中で450℃で6時間加熱) などの分解反応で合成することもできます。
-
使用上の注意
アルゴン封入
-
化学的特性
finely divided white powder(s) or crusty material; readily absorbs CO2 and H2O from the atmospheric; made by heating LiOH to ~800°C in a vacuum or by thermal decomposition of lithium peroxide; used in ceramics and special glass formulations and in lithium thermal batteries [HAW93] [MER06] [KIR81] [FMC93]
-
使用
Lithium oxide is a strong alkali that absorbs carbon dioxide and water
from the atmosphere. It is used in manufacturing ceramics and special types of glass.
-
製造方法
Industrial and laboratory preparations. Only small volumes of material are prepared
industrially. Both industrial and laboratory preparations require the thermal decomposition
of lithium peroxide or of lithium hydroxide.
Lithium peroxide, Li202 , is converted to lithium oxide, Li20, and oxygen by heating
to 450° in a stream of helium gas.
Thermal dehydration of lithium hydroxide is carried out at 675°C±10° under vacuum
in a nickel container lined with silver foil.
Lithium carbonate may be converted to lithium oxide and carbon dioxide by heating
the material to 700°C under vacuum in a platinum boat.
Industrial uses. There are no current industrial uses which consume large quantities of
lithium oxide.
Lithium oxide reacts with water as it dissolves to form a solution of lithium hydroxide.
Lithium oxide is a strong base and reacts typically with acidic gases and liquids to form
lithium salts. At elevated temperatures, lithium oxide also reacts with many solid nonmetal
oxides (Si02, B2O3, etc.) and metal oxides (A1203 , Fe2C>3, etc.). High-temperature
reactions are the basis for the fluxing action of lithium oxide, lithium hydroxide and
lithium carbonate. Care must be taken to avoid the reaction of lithium oxide with reaction
vessels at high temperatures.
-
一般的な説明
Lithium oxide is a white crystalline solid. Its a strong base. It reacts with water and forms lithium hydroxide.
-
化学反応
酸化リチウムは、水蒸気および二酸化炭素を吸収しやすい性質がある物質です。二酸化炭素との反応によって炭酸リチウムを生成します。また、水とは徐々に反応して、水酸化リチウムを与えます。
光によって変質する恐れがあるため、保管環境においては高温と直射日光を避ける必要があります。また、強酸化剤は混触危険物質であり、想定される危険有害な分解生成物は金属酸化物です。
-
有害性と法規制情報
酸化リチウムは、GHS分類において以下に指定されています。
- 急性毒性-吸入 (粉じん/ミスト) : 区分3
- 皮膚腐食性/刺激性: 区分1
- 眼に対する重篤な損傷性/眼刺激性: 区分1
- 生殖毒性: 区分1A
- 特定標的臓器毒性 (単回ばく露) : 区分1
上記のように、人体への有害性が高い物質です。取り扱いの際は、保護メガネ、保護手袋や防塵マスクなどの適切な個人用保護具を用い、使用環境ではよく換気を行います。
また、取扱い後には顔や手など、 ばく露した皮膚を洗う必要があります。目に入った場合は、コンタクトレンズの着用有無に関わらずまず水で数分間注意深く洗浄することが必要です。
毒物及び劇物取締法や、消防法、労働安全衛生法などでの指定はありませんが、危険物船舶運送及び貯蔵規則や、航空法では、腐食性物質に指定されています。法令を遵守して適切に取り扱うことが必要です。
-
使用用途
酸化リチウムの主な使用用途は、導電性ガラス、電池、固体電解質の製造などです。釉薬にも用いられ、銅と混合して青色に、コバルトと混合してピンクを出すのに用いられています。
熱遮蔽コーティング (Thermal barrier coating; TBCs) においては非破壊的発光分光分析検査や劣化の評価に用いられる場合があります。また、ジルコニアコーティングにおいては、酸化イットリウムと共にドーピング剤として用いられる物質です。
-
参考文献
E. Zintl, A. Harder, B. Dauth, Z. Electrochem., 40, 588 (1934).