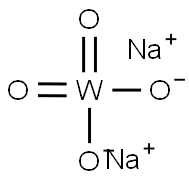-
種類
タングステン酸ナトリウムは、研究開発用試薬製品や工業用触媒原料などとして一般に販売されています。無水物が販売されていることはほとんど無く、水和物や水溶液がメインです。
1. 研究開発用試薬製品
研究開発用試薬製品は、タングステン酸ナトリウム・二水和物の形で主に販売されています。それ以外では、二水和物にして9.3%程度の濃度の水溶液の状態で販売されていることもあります。
2. 工業用製品
工業用としては、主に触媒原料などの用途で販売されています。二水和物が販売されることが多く、主な用途は塩基性染料媒染剤、金属表面処理剤、窯業用副原料などです。
-
性質
タングステン酸ナトリウムは、分子量293.836、融点698℃で、常温においては白色の固体です。水に溶けやすい物質であり、水への溶解度は、57.5g/100 mL (0℃) です。
水溶液はアルカリ性を示します。また、クロム酸塩よりもはるかに弱い、弱い酸化剤として作用します。
-
解説
普通は,Na2WO4(293.82).テトラオキシドタングステン酸(2-)ナトリウム(通称,オルトタングステン酸ナトリウム)をさす.そのほか,多くのポリタングステン酸([別用語参照]ポリ酸)塩が知られている.Na2WO4は,WO3とNaOH,またはNa2CO3との混合物を加熱融解するか,Na2CO3水溶液にWO3を加えて溶かし,溶液を濃縮すると得られる.水溶液から析出する結晶は,6 ℃ 以下では十水和物,それ以上では二水和物になる.十水和物結晶は,6 ℃ 以上では不安定である.二水和物を100 ℃ に加熱すると無水物になり,さらに加熱するといくつかの変態を経る.無水物は立方晶系で,スピネル型構造.W-O1.82 Å.融点698 ℃.密度4.18 g cm-3.変態もある.二水和物は白~無色の斜方晶系結晶.Wは4Oと2H2Oによる正八面体型六配位.W-O1.79~1.88 Å.Naも6個のO原子に囲まれている.密度3.482 g cm-3.水に可溶.水溶液は pH 8~9.二水和物は乾燥空気中では風解する.織物の耐火加工,関連物質(ヘテロポリ酸など)の合成原料,おもに生物化学関係の試薬(アルカロイドの沈殿試薬など)に用いられる.森北出版「化学辞典(第2版)
-
用途
塩基性染料媒染剤、金属表面処理剤、窯業用副原料、触媒 (化学工業日報社)
-
合成
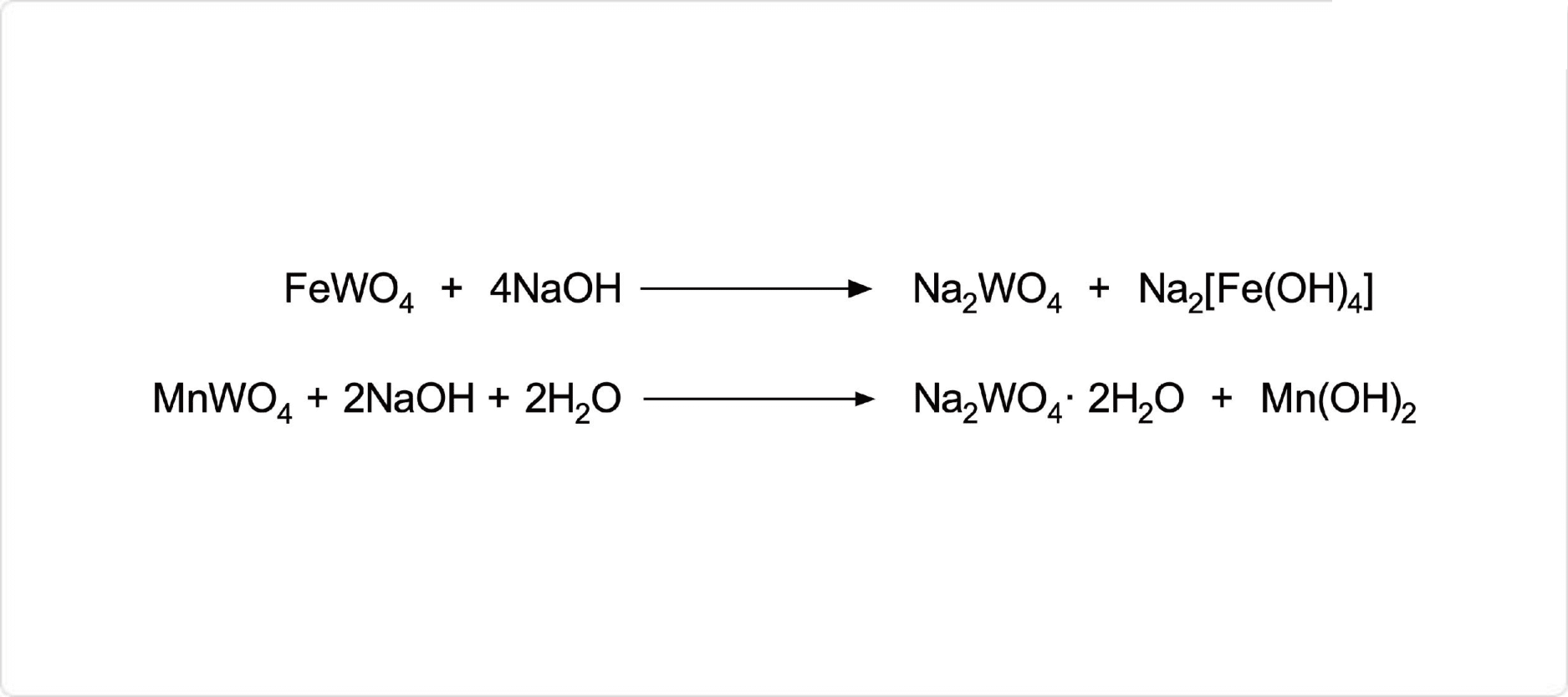
図1. タングステン酸ナトリウムの合成
タングステン酸ナトリウムは、工業的には鉄マンガン重石などの鉱石を水酸化ナトリウムあるいは炭酸ナトリウムと共に融解させ、水酸化ナトリウム水溶液で抽出することで粗製品が製造されています。
それ以外の製造・合成方法としては、と、またはとの混合物を加熱融解する反応があります。あるいは、炭酸ナトリウム水溶液に酸化タングステンを加えて溶かした後、溶液の濃縮により得ることも可能です。
-
化学的特性
Sodium tungstate is a sodium salt of orthotungstate. It is a colorless crystals or white crystalline powder. Soluble in water; insoluble in alcohol and acids. noncombustible. Sodium tungstate has three crystalline forms, δ, γ and β. The transition temperature from δ to γ is about 570℃, and from γ to β is about 585℃. In hydrogen is heated to 700 ℃ also does not change, to 1100 ℃ will become metal tungsten.
-
使用
Intermediate in preparation of tungsten compounds, (e.g., phosphotungstate), reagent, fire-proofing fabrics and cellulose, alkaloid precipitant.
-
定義
ChEBI: Sodium tungstate is an inorganic sodium salt having tungstate as the counterion. Combines with hydrogen peroxide for the oxidation of secondary amines to nitrones. It has a role as a reagent. It contains a tungstate.
-
製造方法
Sodium tungstate is obtained by digestion of tungsten ores, the economically important representatives of which are tungstates, in base. Illustrative is the extraction of sodium tungstate from wolframite:
Fe/MnWO4 + 2 NaOH + 2 H2O → Na2WO4?2H2O + Fe/Mn(OH)2
Sodium tungstate can also be produced by treating tungsten carbide with a mixture of sodium nitrate and sodium hydroxide in a fusion process which overcomes the high exothermicity of the reaction involved.
-
化学反応
タングステン酸ナトリウムは、塩酸と反応すると三酸化タングステンやその水和物を生成することが知られています。三酸化タングステンは酸化タングステン(VI) とも呼ばれ、分子式WO3で表される物質です。三酸化タングステンも、工業的に広く使用されています。
-
化学性质
色結晶,100℃で水和物となる。水に可溶で,弱塩基性を示す。
-
使用用途
タングステン酸ナトリウムは、タングステン鉱石からタングステンを抽出する場合の重要な中間生成物という位置づけです。主な用途は、塩基性染料媒染剤、金属表面処理剤、窯業用副原料、触媒などです。
また、組織細胞化学において、染色剤/電子染色剤として用いられます。
それ以外では、微生物実験で培地の作成する場合に微生物の飼育に必要なタングステン分を補うサプリメントとして使用されます。タングステン酸ナトリウムは、血糖値降下作用も有しているとされています。
-
安全性プロファイル
Poison by ingestion, intravenous, intramuscular, and subcutaneous routes. Experimental reproductive effects. Mutation data reported. When heated to decomposition it emits toxic fumes of Na2O. See also TUNGSTEN COMPOUNDS.
-
合成方法
タングステン酸塩を主成分とする鉱石を酸処理してタングステン酸としたのち,アルカリ抽出してタングステン酸ナトリウムの溶液を得る。これを精製してタングステン酸を得,アンモニア水あるいはカセイソーダ(水酸化ナトリウム)溶液に溶解し,溶液を濃縮して結晶を析出させる。