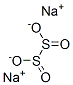-
外観
白色の粉末
-
性質
次亜硫酸ナトリウムは、常温では白色結晶です。亜硫酸ガスと同様の刺激臭がします。引火点は100°C、発火点は200°Cです。
次亜硫酸ナトリウムはにわずかに溶け、水に溶けやすいです。融点は52°Cで、空気中で90℃以上に加熱することで、とに分解されます。空気がない場合には、150℃以上で亜硫酸ナトリウム、、二酸化硫黄、微量の硫黄に激しく分解されます。
-
溶解性
水に溶けやすく、エタノールに微溶。水に溶けやすく、エタノールに溶ける。
-
解説
亜ジチオン酸ナトリウム,アジチオンサンナトリウム,Na2S2O4(174.11).ハイドロサルファイトともいう.亜鉛末を冷水に懸濁させ,これに二酸化硫黄を通した後,水酸化ナトリウムで中和し,生じた水酸化亜鉛を濾過し,濾液に塩化ナトリウムを加えると二水和物が析出する.沈殿を含む液を60~70 ℃ に加熱すると無水物が得られる.[S2O4]2- の構造は,SO2-SO2型で,双方のSO2のO…Oはほぼ平行で両平面は約30°開き,S-S2.39 Å,S-O1.15 Å.二水和物は単斜晶系の結晶.無水物は粉末.密度2.37 g cm-3.いずれも無色.水に易溶.固体は乾燥空気中ではかなり安定であるが,湿気があるとNaHSO4とNaHSO3に酸化される.強い還元作用を示す.還元剤としてインジゴのような建染め染料による染色,絹,羊毛,繊維,麦ワラなどの漂白に用いられる.還元剤として染色工業で用いられるロンガリット(ヒドロキシメタンスルフィン酸ナトリウム)の製造原料として重要である.
-
用途
染色助剤(建染染料などの)、還元洗浄剤(合成繊維などの)、漂白剤(紙?パルプなどの)、ガス分析用(酸素吸収剤)、ロンガリットやスーパーライトの製造原料、抜染剤、石けん 医薬品(サルバルサン)、食品の漂白
-
用途
染料・繊維・食品工業での還元剤や漂白剤として広く用いられる。
-
構造
次亜硫酸ナトリウムの化学式はNa2S2O4、モル質量は174.107、密度は2.19g/cm3です。次亜硫酸ナトリウムの無水物は、白色の単斜晶です。二水和物も知られており、黄色味がかった柱状結晶ですが、容易に脱水して無水物になります。さらに二水和物は空気中の酸素によって酸化されやすいため、不安定です。
次亜硫酸ナトリウムの無水物は、C2対称構造を取り、ねじれ角16°の重なり形配座です。その一方で二水和物は、ねじれ角56°のゴーシュ配座になっています。
-
化学的特性
White solid
-
使用
Sodium dithionite is a reducing agent for vat dyes,reducing hair bleaching agents,vat dyes printing auxiliaries, silk scouring and bleaching agents, coloring agents and objects stripping vat cleaning agent, particularly in dyeing with indigo and vat dyes; bleaching soaps, straw; removing dyes from dyed fabrics.
-
定義
ChEBI: An inorganic sodium salt that is the disodium salt of dithionous acid.
-
製造方法
Sodium dithionite is today produced mainly from sodium formate and sulfur dioxide. Zinc dithionite, prepared on-site from sulfur dioxide and zinc dust, was formerly more important than the sodium salt. The heavy metal zinc ended up in the effluent, which caused environmental problems. Today in pulp mills on-site production of zinc dithionite is no longer practiced. The number of plants using sodium amalgam and sulfur dioxide for dithionite production is decreasing with the number of amalgam cells in electrolysis. On-site generation of dithionite from alkaline sodium borohydride solution, sodium bisulfite, and sulfur dioxide is used by some mills.
Sodium dithionite is available as crystalline powder (&90% Na2S2O4) or as a refrigerated 150 g/L solution stabilized with alkali. The white crystals can decompose on heating. Low alkalinity, pH8 to 13, stabilizes dithionite solution at low temperature.
These solutions should be kept well below 10 °C with the exclusion of air. In presence of air, oxidation rapidly yields sulfate and sulfite.
The powder product prepared via the amalgam route dissolves into an alkaline solution as it contains sodium carbonate and sulfite. This can trigger the precipitation of calcium carbonate (water hardness) in the solution tank. Therefore, it is recommended to add small amounts of chelants during the dissolution step. (Chelants are not required to stabilize the bleaching reaction.) Sodium dithionite prepared by the formate route dissolves into a slightly acidic solution. Dithionite powder can ignite if exposed to high humidity or elevated temperature.
-
調製方法
An alternative route for dithionite production is the reduction of sodium bisulfite with sodium borohydride. Sodium borohydride is obtained by reacting boron trimethyl ester, B(OCH3)3, with sodium hydride, NaH. The resulting product is hydrolyzed with water, and methanol is evaporated. An alkaline, aqueous solution is obtained, containing about 12% NaBH4 and 40% NaOH. This solution is commercially available. Reaction to dithionite is made on-site by adding sulfur dioxide and some additional caustic soda. Storages, handling and mixing of sulfur dioxide and of the Borol® liquid are not everywhere cost competitive.
NaBH4+8NaOH+8SO2 → 4Na2S2O4+NaBO2+6H2O.
-
一般的な説明
Sodium dithionite is a whitish to light yellow crystalline solid having a sulfur dioxide-like odor. Sodium dithionite spontaneously heats on contact with air and moisture. This heat may be sufficient to ignite surrounding combustible materials. Sodium dithionite is soluble in water. Under prolonged exposure to fire or intense heat containers of Sodium dithionite may violently rupture. Sodium dithionite is used in dyeing and to bleach paper pulp.
-
反応プロフィール
Inorganic reducing agents, such as Sodium dithionite, react with oxidizing agents to generate heat and products that may be flammable, combustible, or otherwise reactive. Their reactions with oxidizing agents may be violent. Sulfites and hydrosulfites (dithionites) can react explosively with strong oxidizing agents (sodium chlorite). Sulfites generate gaseous sulfur dioxide in contact with oxidizing acids and nonoxidizing acids.
-
危険性
Fire risk in contact with moisture. To extin-
guish fires, flood the reacting mass with water.
-
健康ハザード
Fire will produce irritating, corrosive and/or toxic gases. Inhalation of decomposition products may cause severe injury or death. Contact with substance may cause severe burns to skin and eyes. Runoff from fire control may cause pollution.
-
火災危険
Flammable/combustible material. May ignite on contact with moist air or moisture. May burn rapidly with flare-burning effect. Some react vigorously or explosively on contact with water. Some may decompose explosively when heated or involved in a fire. May re-ignite after fire is extinguished. Runoff may create fire or explosion hazard. Containers may explode when heated.
-
使用用途
次亜硫酸ナトリウムはと同様に、食品添加物として食品加工で使用されることが多いです。最も多い利用は、ワインなどの飲料における酸化防止剤です。
また、水に溶けやすく、強力な還元作用を持つことから、漂白剤や変色防止剤として使用されることもあります。食品の色調を整えたり、原料などに含まれる好ましくない色素成分や着色物質の色を無色にしたりすることも可能です。
世界における次亜硫酸ナトリウムのうち、半分が織物の染色や漂白に、3分の1がパルプや紙の漂白などに使用されています。なお、次亜硫酸ナトリウムは、工業的には金属亜鉛を仲介したとナトリウム塩の反応によって精製されます。
-
安全性プロファイル
Toxic and an irritant. An allergen. Flammable when exposed to heat or flame. Ignites on contact with water or sodium chlorite. To extinpsh fires, flood the reacting mass with water. Decomposes violently when heated to 19OOC and emits toxic fumes of SOx and NazO
-
貯蔵
Sodium dithionite crystals are available in steel containers (1 or 2 tons) or in steel drums (200 kg). Because of the danger of spontaneous ignition in humid air, sodium dithionite must be stored under dry and cool conditions. The sites for the preparation of dithionite solutions must permit handling without risks, high humidity should be avoided and remote fire control should be available.
Commercial dithionite products are classified as self-igniting hazardous goods (Class 4.2, UN 1384). Local rules for transportation and storage must be obeyed.
-
合成方法
1. 亜鉛塵法による合成
の粉末を水に懸濁させ、二酸化硫黄を通すことで、亜鉛が溶け、亜ジチオン酸亜鉛になります。やを加えることで、 (II) の白色沈澱として亜鉛を析出させて、減圧濃縮後にとを加えると、次亜硫酸ナトリウムの無水物が析出します。
2. ギ酸ソーダ法による合成
ギ酸ソーダ法は三菱ガス化学が実用化した方法です。ギ酸ナトリウムを80%のメタノールに溶かして、水酸化ナトリウムと二酸化硫黄を加えると、次亜硫酸ナトリウムの無水物が析出します。多価アルコールを製造する際に副生成物としてギ酸ナトリウムが得られるため、亜鉛塵法よりも低コストなことが利点です。
3. アマルガム法による合成
食塩電解槽で作成したナトリウムアマルガムを、亜硫酸水素ナトリウム水溶液に接触させて、還元することにより次亜硫酸ナトリウムが得られます。
4. 水素化ホウ素ナトリウム法による合成
強アルカリ水溶液中において安定な還元剤である水素化ホウ素ナトリウムに、二酸化硫黄と水酸化ナトリウムを加えることで、次亜硫酸ナトリウムが生成します。
5. 電解法による合成
半透膜で仕切られた電解槽を用いて、二亜硫酸イオンを還元すると、次亜硫酸ナトリウムが生じます。
参考文献