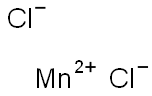-
性質
塩化マンガンの無水物は、潮解性の淡赤色結晶です。融点は654°Cで、沸点は1,225°Cです。
に溶け、25°Cの水100gに77.2g溶解し、水溶液はpH4ほどの弱酸性を示します。水溶液から淡赤色の四水和物であるMnCl2・4H2Oの結晶が得られます。色が薄い理由は、ハイスピン型であるd5電子配置のためです。4水和物は、ペンキ、印刷インキの乾燥剤、顔料、電池用二酸化マンガンの原料などに使用可能です。
塩化マンガン(II)はさまざまなマンガン化合物の合成に利用可能です。具体的には、炭酸カリウムと反応して、炭酸マンガン(II)が沈殿します。この反応中のMnCl2のマンガンイオンは、水和して[Mn(H2O)6]2+になっています。弱いルイス酸である塩化マンガン(II)は、塩化物イオンとの反応によって、[MnCl6]4−、[MnCl4]2−、[MnCl3]−などの錯イオンを生成可能です。
-
定義
本品は、次の化学式で表される無機塩である。
-
解説
塩化マンガン,薄桃色の結晶(六方晶系).密度2.98 g cm-3.融点650 ℃,沸点1190 ℃.常磁性が強く,磁化率χ = 110.95×10-6 e.m.u..水に易溶,エタノールに可溶,エーテルに不溶.水溶液を58 ℃ 以下で濃縮すると四水和物が得られる.四水和物は薄桃色の結晶(単斜晶系)で,α形(安定),β形(不安定)の2変態がある.水に易溶,エタノールに可溶,エーテルに不溶.塩素化触媒,顔料,塗料,染料,印刷インキの乾燥剤,フラックス,パッチテスト試薬などに用いられる.
森北出版「化学辞典(第2版)
-
用途
情報なし
-
構造
塩化マンガンの化学式はMnCl2で表されます。モル質量は125.844g/molで、密度は2.98g/cm3です。結晶構造は六方晶系の塩化カドミウム型を取っています。塩化マンガンは常磁性です。
塩化マンガンには無水物以外にも、2水和物や4水和物が存在します。
-
合成
塩化マンガン(II)の合成法
天然にはベスビオ火山などで、スカッチャイト (英: scacchite) として塩化マンガン(II)が産出します。
塩化マンガン(II)の無水物の塩は、塩素と金属の反応によって得られます。金属マンガン、マンガン酸化物、炭酸マンガンに塩化水素を反応させても生成可能です。
濃塩酸と酸化マンガン(IV)を加熱すると、塩化マンガン(II)が生じます。塩酸により4価のマンガン塩が2価に還元されて、マンガンにより塩化物イオンが塩素に酸化される反応です。かつては塩素の製造法に利用されていました。
-
製造
塩化マンガン,熱した金属マンガン,酸化マンガン(Ⅱ),炭酸マンガン(Ⅱ)などに塩化水素ガスを作用させて得られる.
-
説明
Manganese, an essential nutrient, occurs in many foods of plant
and animal origin. The naturally occurring manganese levels vary
from about 2 0 ppm in nuts, cereals, dried fruits and non-leafy
vegetables to less than 1 ppm in animal products.
Manganous chloride tetrahydrate is pink translucent crystals which
are very soluble in water.1
.
-
化学的特性
MnCl2 is rose-colored deliquescent crystals that are very soluble in water,and melts at 650°C and boils at 1190°C. The tetrahedral form, MnCI2.4H20 , melts at 58°C and loses its water at 198°C and is used as a catalyst in paints,dyes,pharmaceuticals, and fertilizers, and for various other purposes.
-
使用
Manganese Chloride is a source of manganese that functions as a
nutrient and dietary supplement. it exists as crystals which are readily
soluble in room temperature (22°c) water and are very soluble in
hot water. see manganese.
-
一般的な説明
Manganese (II) chloride (MnCl2) might play a key role in integrin activation. Manganese is indispensable for brain function and is an essential cofactor for several key enzymes like superoxide dismutase and enzymes involved in neurotransmitter synthesis. Manganese can modulate iron and calcium homeostasis. Manganese is also used in the magnetic resonance imaging to increase contrast while examining neuronal connections and brain cytoarchitecture. High levels of manganese is toxic to central nervous system and causes Parkinson′s like symptoms called as manganism. MnCl2 has been used in reverse transcription reaction mix to enhance the template-switching efficiency.
-
使用用途
塩化マンガン(II)は幅広く使用されています。主な用途は、染色工業、窯業用顔料、医薬品製造、塩化物合成の触媒です。また、塗料乾燥剤 (褐色ピグメント) や塗料乾燥剤のホウ酸マンガンの製造にも使用可能です。
化学肥料の合成促進剤、印刷インキの乾燥剤、乾電池の原料、軽合金用フラックス、、にも用いられています。医療でも、核磁気共鳴画像法 (MRI) 用造影剤や無機質性剤として使用されています。
-
関連する反応
塩化マンガン(II)の反応
有機化合物の配位子と反応すると、空気酸化によって3価のマンガン錯体が形成されます。例えば、[Mn(EDTA)]− (EDTA錯体) 、[Mn(acac)3] (アセチルアセトナト錯体) 、[Mn(CN)6]3− (シアン化物錯体) などが有名です。トリフェニルホスフィンと反応すると、不安定な1:2付加物が生じます。
塩化マンガン(II)の無水物は、禁水条件の反応に使用されます。ナトリウムシクロペンタジエニドとの反応では、マンガノセン (英: Manganocene) を合成可能です。マンガノセンとはビス(シクロペンタジエニル)マンガン(II)とも呼ばれる有機マンガン化合物であり、化学式は[Mn(C5H5)2]nと表されます。
-
安全性プロファイル
Poison by
intraperitoneal, subcutaneous, intramuscular,
intravenous, and parenteral routes.
Moderately toxic by ingestion. Experimental
teratogenic and reproductive effects.
Questionable carcinogen with experimental
carcinogenic data. Mutation data reported.
Explosive reaction when heated with zinc
foil. Reacts violently with potassium or
sodium. When heated to decomposition it
emits toxic fumes of Cl-. See also
MANGANESE COMPOUNDS and
CHLORIDES.
-
特徴
塩化マンガン(III)の特徴
酢酸マンガンに-100°Cで塩化水素を反応させると、塩化マンガン(III)が得られます。化学式はMnCl3で、黒色粉末で熱的に不安定です。
塩化マンガン(II)の濃塩酸溶液と塩素が反応して生じる褐色溶液には、塩化マンガン(III)のクロロ錯体 (MnCl52-など) が含まれています。
-
純化方法
It crystallises from water (0.3mL/g) on cooling. The red-rose tetrahydrate melts at ~52o and forms the dihydrate salt which loses all its H2O at 198o to give MnCl2. It is soluble in EtOH.
-
参考文献
J.D. Tornero, J. Fayos, Z. Krystallogr., 192, 147 (1990), DOI: 10.1524/zkri.1990.192.14.147.