病毒系统定制服务
发布日期:2020/2/19 8:06:22
背景[1-6]
病毒系统定制服务是通过QVirusTM病毒包装技术将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。常用的有慢病毒、腺病毒、腺相关病毒和逆转录病毒。病毒载体是指以病毒为基础的载体,也是目前最常用的基因导入方式之一。通过对病毒基因组的遗传改造,使之能够携带外源目的基因和相关的病毒元件,并被包装成病毒颗粒。病毒进而侵染宿主,使携带的外源基因在宿主体内表达。
病毒的基因组可分为编码区和非编码区。其中,编码区包含病毒的必需基因和非必需基因,可分别表达产生病毒的结构蛋白和非结构蛋白;非编码区则含有病毒复制和包装所需的全部顺式作用元件。
由于野生型病毒常常具有致病性,为了避免实验或治疗中使用的病毒恢复成野生型,必须对病毒载体进行一系列的遗传改造。譬如删除病毒基因组的非必需区,将顺式作用元件和反式作用元件分开连接至不同的载体上,或结合利用不同种病毒的必需蛋白等,程度地保证实验的安全性。
哺乳动物病毒表达系统常常包含一到多个载体,将所需的载体转染包装细胞后,在反式因子的作用下,病毒复制、包装所需的顺式作用元件和外源基因表达盒即可被包装,最终产生带有外源基因的病毒颗粒。经浓缩和纯化后的病毒液即可用于侵染目标宿主细胞或动物体,实现外源目的基因在宿主体内的表达。
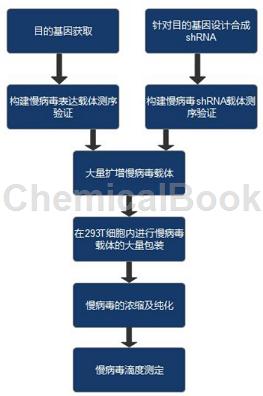
1. 慢病毒服务
人免疫缺陷病毒(Human immunodeficiency virus(HIV,lentivirus)type-1)载体在实际应用中有较多的优点,比如说它们能感染非分裂期的细胞,整合到基因组中实现长时间的基因表达,滴度比原逆转录病毒体系更好,免疫反应小等优点。慢病毒载体还具有转移的基因片段容量较大(9 kb),绝大多数。由于病毒载体删除了包装基因和外壳蛋白后,它不能在宿主细胞增殖,也不会导致细胞的死亡,被它感染的细胞能够连续传代。
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷1型病毒)为基础发展起来的基因治疗载体。具有感染谱广泛,可以有效感染分裂期和静止期细胞,长期稳定表达外源基因等优点,因此成为导入外源基因的有力工具。
2. 腺病毒服务
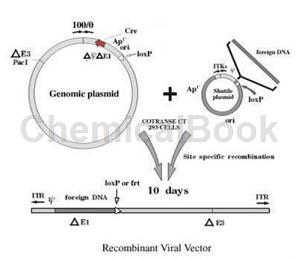
腺病毒载体是E1和E3基因缺失的,所以感染细胞后不会在细胞体内进行复制(转有E1基因的HEK293细胞除外),因而是较为安全的基因治疗载体。其重组腺病毒系统是将携带外源基因的腺病毒穿梭质粒与携带腺病毒基因组的包装质粒共转染HEK293细胞,通过Cre/loxP重组酶系统的作用实现重组,产生重组腺病毒,能够表达较大的外源基因片段,感染分裂与非分裂细胞,宿主范围广。
3. 逆转录病毒服务
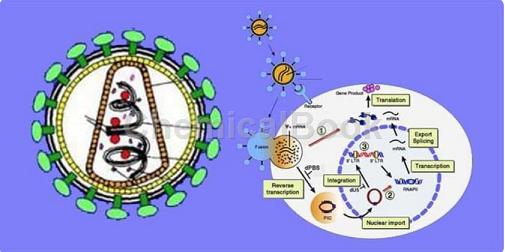
逆转录病毒(Retrovirus)是一类RNA病毒。在逆转录酶的作用下,以病毒RNA为模板合成cDNA,再通过DNA复制、转录、翻译等过程形成病毒颗粒,具有基因组结构简单,便于基因操作、转染效率高、宿主范围广、易于分离等优点。逆转录病毒表达系统是一种新的重组蛋白高效表达系统,在外源基因表达、基因沉默、基因治疗、生物制药等领域中得到广泛的应用,是分子生物学研究的重要工具。逆转录病毒载体的转染范围广,可以将外源基因整合到基因组上,对细胞的感染效率高。
应用[7][8]
病毒系统定制服务可用于RNA干扰通路的HIV治疗研究:
RNA干扰技术通过靶向于结构蛋白或者是调节蛋白,已经有效地应用于HIV的基因治疗。由于siRNA在体内不稳定,很快就被降解,体外合成和质粒介导的RNA干扰持续时间较短,不适用于长期抑制基因表达。通过慢病毒载体表达编码siRNA的shRNA在转录水平下调HIV病毒基因从而抑制病毒复制成为基因治疗HIV一种重要的方式。
将抗病毒基因导入到干细胞的方式对基因治疗达到长期治疗效果提供了希望。在筛选出针对HIV-1的tat、vpr和rev特异性siRNA的基础上,本研究分别构建了含有相应shRNA序列的重组慢病毒表达质粒,并对靶向基因的干扰效果进行了检测。在此基础上,在293T细胞中包装出含有相应shRNA序列的重组慢病毒并测定病毒滴度。将得到的重组慢病毒感染MT-4细胞,通过嘌呤霉素抗性筛选得到稳定表达siRNA的MT-4细胞系,进行HIV-1NL4-3毒株体外攻击试验,通过检测培养上清中的P24蛋白含量来比较siRNA体外抑制病毒效果。
结果表明,靶向于vpr的shRNA可以在转录水平上有效地抑制vpr的表达,抑制率达到88.8%;靶向于tat的shRNA抑制率达到60.2%;稳定表达vprshRNA或tatshRNA的MT-4细胞系能够有效地抑制HIV的复制,短期内培养基中没有HIV的大量复制。基于HARRT治疗的经验,将多个抗HIV基因联合应用同样可能起到更好的抗病毒效果,因此本研究还构建了同时含有靶向于vpr和tat基因的双shRNA的重组慢病毒表达质粒,分别由人U6启动子和H1启动子控制表达。
体外与含有vpr及tat基因的质粒共转染表明该重组表达质粒对vpr和tat基因在转录水平上的干扰效果分别达到89.2%和62.0%;将重组慢病毒质粒与病毒包装质粒pNL4-3共转染后,P24定量检测结果显示对HIV病毒包装的抑制率可以达到99.05%,比单独表达靶向于vpr的shRNA或靶向tat的shRNA的抑制率都要高;包装出重组慢病毒后感染MT-4细胞,同样筛选稳定表达siRNA的MT-4细胞系,HIVNL4-3病毒攻击实验表明该细胞系可以有效地抑制病毒的复制。
参考文献
[1]Corrigendum to“The LEDGF/p75 integrase interaction,a novel target for anti-HIV therapy”[J].Frauke Christ,Zeger Debyser.Virology.2013
[2]Production of Transgenic Korean Native Cattle Expressing Enhanced Green Fluorescent Protein Using a FIV-Based Lentiviral Vector Injected into MII Oocytes[J].Yong-Nan Xu,Sang-Jun Uhm,Bon-Chul Koo,Mo-Sun Kwon,Ji-Yeol Roh,Jung-Seok Yang,Hyun-Yong Choi,Young-Tae Heo,Xiang-Shun Cui,Joon-Ho Yoon,Dae-Hwan Ko,Teoan Kim,Nam-Hyung Kim.Journal of Genetics and Genomics.2012
[3]Multiple platforms of a HIV-2 derived lentiviral vector for expanded utility[J].Ajit G.Chande,Sumeer Raina,Hemant Dhamne,Rohan H.Kamat,Robin Mukhopadhyaya.Plasmid.2012
[4]Mesenchymal stem cells engineered for cancer therapy[J].Khalid Shah.Advanced Drug Delivery Reviews.2011(8)
[5]Microvesicles and exosomes:Opportunities for cell-derived membrane vesicles in drug delivery[J].Susan M.van Dommelen,Pieter Vader,Samira Lakhal,S.A.A.Kooijmans,Wouter W.van Solinge,Matthew J.A.Wood,Raymond M.Schiffelers.Journal of Controlled Release.2011(2)
[6]Umbilical cord-derived mesenchymal stem cells:strategies,challenges,and potential for cutaneous regeneration[J].Siming Yang,Sha Huang,Changjiang Feng,Xiaobing Fu.Frontiers of Medicine.2012(1)
[7]Current progress and challenges in HIV gene therapy[J].Chung,Janet,Rossi,John J,Jung,Ulrike.Future Virology.2011(11)
[8]郝彦哲.慢病毒介导siRNA和细胞内抗病毒因子对HIV抑制作用研究[D].北京工业大学,2013.
欢迎您浏览更多关于病毒系统定制服务的相关新闻资讯信息
