реактив Гриньяра
Реактив Гриньяра назван в честь его первооткрывателя В.А.Гржинара. Он обладает очень активными химическими свойствами и легко реагирует с водой, двуокисью углерода, спиртами, альдегидами, кетонами, сложными эфирами, аминами и эпоксидными соединениями, образуя различные типы органических соединений с более высокими выходами. Его получают путем реакции между металлическим магнием и алкилгалогенидом в сухом эфирном растворителе по формуле RMgX, R представляет собой алкильную группу, арильную группу или другую органическую группу, X представляет собой группу хлора, брома, йода, такую как эфир. раствор CH3MgI, C2H5MgBr, C6H5MgCl (Br) и так далее. Реактив Гриньяра является важным видом реагентов в области неорганической синтетической химии, а также имеет широкое применение в синтезе органических соединений. При использовании мы должны строго избегать контакта с влажным воздухом и обращать внимание на опасность возгорания.
Связанные химические реакции
1, можно использовать реактив Гриньяра. чтобы иметь реакцию присоединения с различными видами ненасыщенных связей, в дальнейшем производя другой тип продукта. В результате реакции связь C-Mg в реактиве Гриньяра будет разорвана, при этом углеводородная связь будет присоединена к атомам с низкой плотностью электронного облака ненасыщенных соединений, а атомы магния присоединятся к атомам с большой плотностью электронного облака.
2, реактив Гриньяра можно вводить в реакцию с хлоридом свинца. В соответствии с различными количествами реактива Гриньяра и дихлорида свинца он может генерировать дигидрокарбилсвинец из тетраалкилсвинца.
3, реактив Гриньяра реагирует с галогенидом меди с образованием гидрокарбила меди. Галогенид меди может быть иодидом меди, бромидом меди и хлоридом меди.
4, реактив Гриньяра реагирует с дигалогенидом ртути с образованием гидрокарбила ртути с обычным дигалогенидом ртути, включая дибромид ртути и дихлорид ртути. Реакцию проводят в инертном растворителе, таком как этиловый эфир.
5, реактив Гриньяра взаимодействует с равным молярным содержанием галогенида цинка, образуя гидрокарбилгалогенид цинка, а избыточное количество реактива Гриньяра способно генерировать дигидрокарбилцинк. Обычно используемый галогенид цинка представляет собой хлорид цинка, в то время как обычно используемый реактив Гриньяра представляет собой C2H5MgXCH2 = CHMgX, (CH3) 3CMgX и т. д.
6, реактив Гриньяра реагирует с тригалогенидом бора с образованием алкилбора. Галогеном в реактиве Гриньяра может быть F, Cl, Br и I. Тригалогенид бора обычно представляет собой BF3, BCl3. Выход составляет от 50% до 90%. Мы не можем использовать эту реакцию для получения три-трет-бутилбора, потому что при взаимодействии трет-бутилмагнийгалогенида с трихлоридом или трифторидом бора мы получаем продукт перегруппировки - трет-бутилдиизобутилбор или триизобутилбор. бор, механизм которого остается неизвестным.
7, реактив Гриньяра может вступать в реакцию сочетания с другими галогенированными углеводородами с образованием высших углеводородов. Обычно используемые галогенированные углеводороды включают бромуглеводороды и йодоуглеводороды, при этом хлорированные углеводороды достаточно активны. Формула реакции: R-MgX + X-R1 === R-R1 + MgX2.
В этой реакции галогениды металлов являются эффективными катализаторами. Когда R = R1, люди в основном используют серебро в качестве катализатора; когда R ≠ R1 медный катализатор более эффективен. При наличии бромистого винила мы можем выбрать катализатор с высоким содержанием железа. Для неактивных винилгалогенидов или арилгалогенидов мы можем использовать для катализа комплексы двухвалентного никеля с дихлорбис(трифенилфосфином) или дихлорид кобальта. Катализируемый процесс реакции дихлорида кобальта выглядит следующим образом:
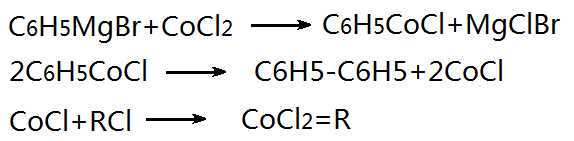
На рисунке 1 представлена схема реакции, катализируемой дихлоридом кобальта.
Способ приготовления
Обычно применяется реакция между металлическим магнием и органическим галогенидом для получения реактива Гриньяра в безводном эфире. RX + Mg = RMgX
Используемое сырье и растворители должны быть полностью сухими. Органические галогениды могут быть алифатическими или ароматическими и т. д., в зависимости от типа галогена или от того, идет ли реакция легко или нет, выход реактива Гриньяра также может варьироваться.
Сложность реакции в основном зависит от типа структуры углеводорода и типа галогена в галогенированном углеводороде. Если углеводород один и тот же, йод наиболее легко вступает в реакцию, а хлор - наиболее трудно вступает в реакцию. Однако при использовании йода могут наблюдаться побочные реакции Вутца и снижаться выходы.
Если галоген тот же, чем больше углеводородная группа, тем сложнее будет реакция. Иногда, чтобы улучшить выход, нам нужно применять низкие концентрации галогенов и низкую температуру для реакций. Чтобы увеличить скорость реакции, можно добавить небольшое количество йода, чтобы инициировать реакцию в начале, как только реакция начнется, поскольку реакция является экзотермической, следует быстро провести охлаждение. Мы также можем использовать небольшое количество 1,2-дибромэтана для замены йода, особенно когда в диэтиловом эфире мало воды, лучше использовать этот метод, потому что образующийся бромид магния обладает дегидратирующим действием.
Что касается растворителя, мы можем использовать диэтиловый эфир, дибутиловый эфир, тетрагидрофуран и анизол. Различные растворители могут напрямую влиять на выход и уровень сложности. По мнению Г. Нормана, тетрагидрофуран является более подходящим и может облегчить процесс использования винилхлорида, хлорбензола для получения реактива Гриньяра, который обычно является трудным, но простым. Это связано с тем, что винилхлорид и хлор, связанный с олефиновым углеродом, не могут реагировать с магнием в эфире, но реакция может происходить в тетрагидрофуране, полученные хлорэтилмагниевые реагенты также известны как реагент Нормана. В дополнение к тетрагидрофурану мы также можем использовать 2-метилтетрагидрофуран в качестве растворителя.
При приготовлении реактива Гриньяра, если его проводить в ксилоле, скорость реакции очень низкая. Однако после добавления небольшого количества эфира скорость реакции станет намного выше. Следовательно, можно считать, что эфир действует как катализатор.
Также доказано, что хлорид магния может реагировать с хлором под давлением с прямым синтезом реактива Гриньяра без растворителей. Мы также можем использовать косвенные методы для его получения. Например, реакция между бромэтилмагнием и активным водородным соединением, таким как ацетилен, может привести к реакции замещения между металлом и водородом с получением бромэтинилмагния. Или он может реагировать с бромидом магния, чтобы вытеснить металл, как показано на рисунке 2:
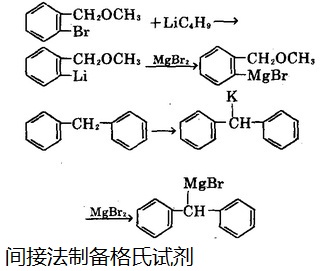
На рисунке 2 показан непрямой процесс приготовления реактива Гриньяра.
- структура:
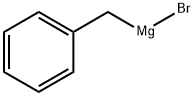
- имя:BENZYLMAGNESIUM BROMIDE
- Номер CAS:1589-82-8
- молекулярная формула:C7H7BrMg
- структура:
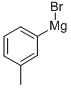
- имя:M-TOLYLMAGNESIUM BROMIDE
- Номер CAS:28987-79-3
- молекулярная формула:C7H7BrMg
- имя:Grignard reagent
- Номер CAS:
- молекулярная формула: