Убиквитин
Убиквитинирование относится к процессу, при котором молекула убиквитина (белок с низкой молекулярной массой) под действием ряда специальных ферментов выполняет классификацию внутриклеточных белков, из которых можно выбрать молекулу белка-мишени, а затем проводит специфическую модификацию белок, специфичный для мишени. Эти специальные ферменты включают фермент, активирующий убиквитин, связанный фермент, ферменты лигазы и фермент деградации. Убиквитинирование играет очень важную роль в локализации, метаболизме, функции, регуляции и деградации белка. В то же время он также может участвовать в регуляции почти всех жизненных процессов, включая клеточный цикл, пролиферацию, апоптоз, дифференцировку, метастазирование, экспрессию генов и регуляцию транскрипции, передачу сигналов, восстановление повреждений и иммунитет к воспалению. Убиквитинирование имеет тесную связь с заболеваемостью раком, сердечно-сосудистыми и другими заболеваниями. Таким образом, как крупное достижение в области биохимических исследований в последние годы, убиквитинирование стало новой целью для исследований и разработки новых лекарств.
Процесс модификации (убиквитинирования) белка играет важную роль. центральную роль в регуляции иммунной системы человека. Как и процесс фосфорилирования, процесс убиквитинирования представляет собой процесс обратимой ковалентной модификации и способен регулировать стабильность, функционально-активный статус и внутриклеточную локализацию модифицированного белка. Следовательно, процесс убиквитинирования также играет важную роль в развитии иммунной системы человека, а также на различных стадиях иммунного ответа, таких как инициация, развитие и окончание иммунного ответа. Результаты недавних исследований показали, что существует несколько убиквитинлигаз, которые, как было обнаружено, участвуют в процессе предотвращения атаки иммунной системы на собственную ткань. Дисфункция этих видов убиквитинлигаз связана с аутоиммунными заболеваниями.
Они должны быть способны эффективно устранять или ограничивать проникновение различных видов патогенов, не прикрепляя саму ткань. Для достижения этой цели очень необходимо, чтобы иммунная система провела тонкую регуляцию. В качестве очень важного регуляторного подхода внутри организмов – Путь модификации убиквитина, несомненно, играет очень важную роль в процессе регуляции иммунной системы. Ранние исследования по этой теме в основном сосредоточены на пути NF-&kB. Исследования последних лет показали, что путь убиквитинирования способен активировать путь NF-&kB через несколько новых сигнальных путей, играющих центральную роль в регуляции активации NF-&kB. Путь NF-βB играет ключевую роль во врожденном и приобретенном иммунитете; поэтому мы также начали осознавать важность регуляции пути убиквитина в иммунной системе.
Белок убиквитина представляет собой высококонсервативный полипептид, состоящий из 76 аминокислотных остатков. Он может вступать в ковалентную связь с одним или несколькими остатками лизина, содержащимися во внутриклеточных белках-мишенях, при последовательном катализе ферментами Е1, Е2, Е3. Сам убиквитин также содержит семь остатков лизина, которые могут соединяться друг с другом через эти сайты, образуя мультиубиквитиновые цепи (полиубиквитиновые цепи). Настоящее исследование показало, что если полиубиквитиновую цепь соединить с 48-м остатком лизина модифицированного белка, то этот процесс будет способствовать включению целевого белка в протеасому и дальнейшей деградации. Если полиубиквитиновая цепь связана с другим участком модифицированного белка, например, с первым остатком лизина 63, белок-мишень может выполнять свою функцию сигнального пути без деградации. Кроме того, некоторые белки, такие как гистон H2A и H2B, после модификации моноубиквитином также могут играть роль в регуляции и не будут разрушаться.
Такой же, как и путь фосфорилирования, путь убиквитинирования является обратимым. , что означает, что организм может принять ферменты деубиквитинирования (DUB) для удаления модификации белка убиквитина. Этот вид обратимых путей модификации очень подходит для использования в качестве механизма регуляции иммунной системы. После того, как целевой белок был подвергнут модификации убиквитинового пути, убиквитиновые мономеры или полимеры, связанные с целевым белком, могут быть распознаны и связаны различными видами убиквитинового домена (UBD). Протеом человека содержит два вида ферментов E1, 50 видов ферментов E2, 600 видов ферментов E3, 90 видов ферментов DUB и 20 видов UBD, что указывает на то, что процесс модификации убиквитина играет очень важную роль в клеточной регуляции. Убиквитин Е3 является ключевым ферментом, определяющим субстратную специфичность в процессе убиквитинирования. Его можно разделить на две категории, а именно ферменты E3, содержащие домен HECT, и другие ферменты E3, содержащие домен RING или RING-подобный домен (например, домен U-box или PHD). Оба этих вида ферментов Е3 играют ключевую роль в процессе иммунной регуляции.
- структура:
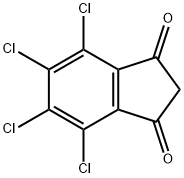
- имя:TCID
- Номер CAS:30675-13-9
- молекулярная формула:C9H2Cl4O2
- структура:
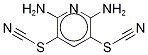
- имя:PR-619
- Номер CAS:2645-32-1
- молекулярная формула:C7H5N5S2
- структура:
![1-[1-(4-Fluorophenyl)-2,5-dimethyl-1H-pyrrol-3-yl]-2-(1-pyrrolidinyl)ethanone](https://www.chemicalbook.com/CAS/GIF/314245-33-5.gif)
- имя:1-[1-(4-Fluorophenyl)-2,5-dimethyl-1H-pyrrol-3-yl]-2-(1-pyrrolidinyl)ethanone
- Номер CAS:314245-33-5
- молекулярная формула:C18H21FN2O
- структура:
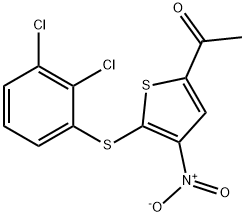
- имя:P5091
- Номер CAS:882257-11-6
- молекулярная формула:C12H7Cl2NO3S2
- структура:
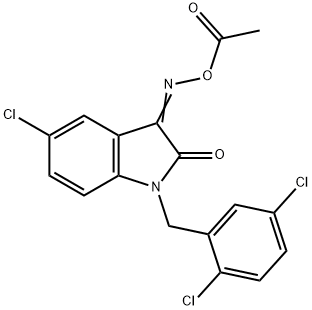
- имя:LDN-57444
- Номер CAS:668467-91-2
- молекулярная формула:C17H11Cl3N2O3
- структура:
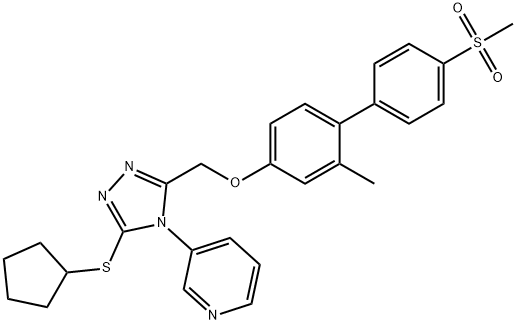
- имя:NMS-873
- Номер CAS:1418013-75-8
- молекулярная формула:C27H28N4O3S2
- структура:
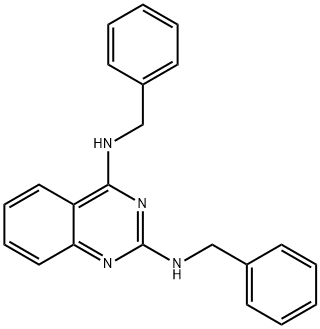
- имя:DBeQ
- Номер CAS:177355-84-9
- молекулярная формула:C22H20N4
- структура:
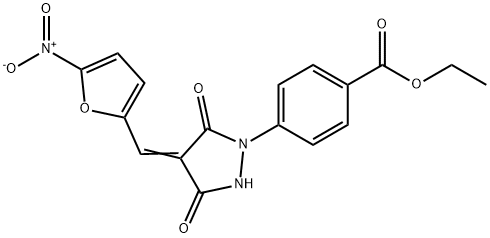
- имя:PYR-41
- Номер CAS:418805-02-4
- молекулярная формула:C17H13N3O7
- структура:
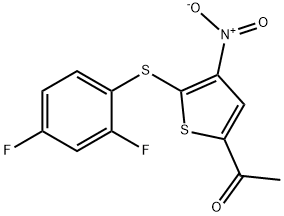
- имя:P 22077
- Номер CAS:1247819-59-5
- молекулярная формула:C12H7F2NO3S2
- структура:
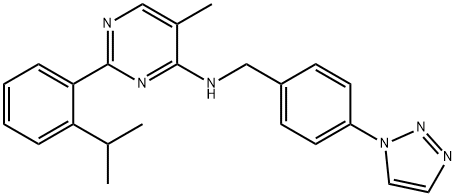
- имя:ML323
- Номер CAS:1572414-83-5
- молекулярная формула:C23H24N6
- структура:
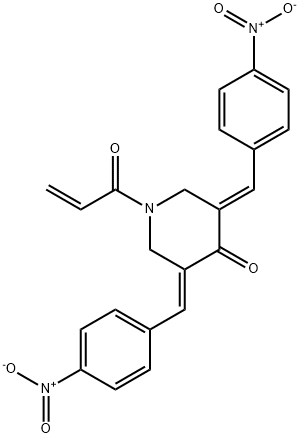
- имя:b-AP15
- Номер CAS:1009817-63-3
- молекулярная формула:C22H17N3O6
- структура:
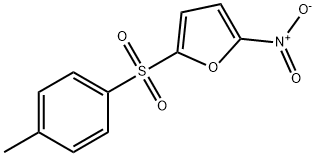
- имя:NSC697923
- Номер CAS:343351-67-7
- молекулярная формула:C11H9NO5S