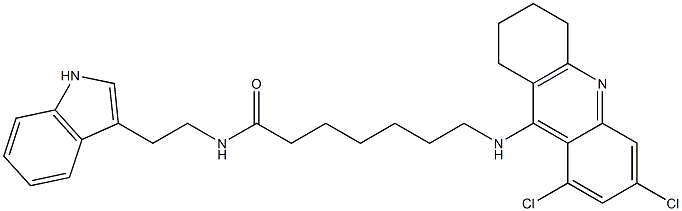
АМИНОАЦИЛАЗА
- английское имяAminoacylase
- CAS №9012-37-7
- CBNumberCB3458624
- ФормулаC30H34Cl2N4O
- мольный вес537.52316
- EINECS232-732-3
- номер MDLMFCD00081285
- файл Mol9012-37-7.mol
| температура хранения | 2-8°C |
| форма | salt-free, lyophilized powder |
| цвет | yellow-brown |
| Конкретная деятельность | 300-1,500units/mg protein |
| Рейтинг продуктов питания EWG | 1 |
| Система регистрации веществ EPA | Aminoacylase (9012-37-7) |
| UNSPSC Code | 12352204 |
| NACRES | NA.54 |
| Коды опасности | Xn |
| Заявления о рисках | 36/37/38-42 |
| Заявления о безопасности | 22-24/25-36/37-26-24 |
| WGK Германия | 3 |
| RTECS | BF4890000 |
| F | 3-10-21 |
| кода HS | 35079090 |
рисовальное письмо(GHS)
-
рисовальное письмо(GHS)


-
сигнальный язык
опасность
-
вредная бумага
H315:При попадании на кожу вызывает раздражение.
H319:При попадании в глаза вызывает выраженное раздражение.
H335:Может вызывать раздражение верхних дыхательных путей.
H334:При вдыхании может вызывать аллергическую реакцию (астму или затрудненное дыхание).
-
оператор предупредительных мер
P261:Избегать вдыхания пыли/ дыма/ газа/ тумана/ паров/ аэрозолей.
P264:После работы тщательно вымыть кожу.
P271:Использовать только на открытом воздухе или в хорошо вентилируемом помещении.
P302+P352:ПРИ ПОПАДАНИИ НА КОЖУ: Промыть большим количеством воды.
P304+P340+P312:ПРИ ВДЫХАНИИ: Свежий воздух, покой. Обратиться за медицинской помощью при плохом самочувствии.
P305+P351+P338:ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промыть глаза водой в течение нескольких минут. Снять контактные линзы, если Вы ими пользуетесь и если это легко сделать. Продолжить промывание глаз.
АМИНОАЦИЛАЗА химические свойства, назначение, производство
Описание
Aminoacylase-1 (EC 3.5.1.14) is a homodimeric zinc-binding metalloenzyme. A cytosolic enzyme with a wide range of tissue expression, it cleaves acylated L-amino acids (except L-aspartate) into L-amino acids and an acyl group. L-aspartate derivatives are cleaved by aminoacylase-2 (aspartoacylase). Aminoacylase-1 is the most abundant of the aminoacylases, a class of enzymes involved in hydrolysis of N-acetylated proteins.Использование
Acylase I from porcine kidney has been used to study the acylase I-catalyzed deacetylation of various S-alkyl-N-acetyl-L-cysteines and their carbon and oxygen analogues . Acylase I may be useful to catalyze N-acetyl amino acids to enantiomerically pure L-amino acids .прикладной
Acylase I from porcine kidney has been used to study the acylase I-catalyzed deacetylation of various S-alkyl-N-acetyl-L-cysteines and their carbon and oxygen analogues . Acylase I may be useful to catalyze N-acetyl amino acids to enantiomerically pure L-amino acids.Биологические функции
Aminoacylases (N-acyl-L-amino acid amidohydrolases; EC 3.5.1.14) are widely found in animals, plants and microorganisms. The primary function of these enzymes is to remove acyl residues from N-acetylated amino acids although they may also be capable of hydrolysing carboxylic acid amides to fatty acid anions and L-amino acids. Although the catalytic mechanism of aminoacylases has been known for decades, the physiological role of these enzymes is still poorly understood. Activities of a similar nature, however, have been found in certain carboxypeptidases, aminopeptidases and dipeptidases. It could be therefore suggested that aminoacylases have a role to play in protein/peptide turnover.Общее описание
Acylase I belongs to the aminoacylase family of enzymes.Ферментативный ингибитор
Aminoacylase is a metallo-enzyme that needs Zinc (Zn2+) as a cofactor to function. The Zinc ions inside of aminoacylase are each coordinated to histidine, glutamate, aspartate, and water. The Zinc ion polarizes the water, facilitating its deprotonation by a nearby basic residue. The negatively charged hydroxide ion is nucleophilic and attacks the electrophilic carbonyl carbon of the substrate's acyl group.The exact mechanism after this point is unknown, with one possibility being that the carbonyl then reforms, breaks the amide bond, and forms the two products. At some point in the mechanism, another water molecule enters and coordinates with Zinc, returning the enzyme to its original state.The nucleophilic attack by water is the rate-limiting step of aminoacylase's catalytic mechanism. This nucleophilic attack is reversible while the subsequent steps are fast and irreversible. This reaction sequence is an example of Michaelis–Menten kinetics, allowing one to determine KM, Kcat, Vmax, turnover number, and substrate specificity through classic Michaelis-Menten enzyme experiments. The second and third forward steps cause the formation and release of the reaction's products.
АМИНОАЦИЛАЗА запасные части и сырье
АМИНОАЦИЛАЗА поставщик
| поставщик | телефон | страна | номенклатура продукции | благоприятные условия |
|---|---|---|---|---|
| +86-0371-86658258 +8613203830695 |
China | 29871 | 58 | |
| 86-13657291602 | CHINA | 22963 | 58 | |
| +86-023-6139-8061 +86-86-13650506873 |
China | 39894 | 58 | |
| 1-516-855-7709 | United States | 8748 | 58 | |
| +86-0551-65418671 +8618949823763 |
China | 34563 | 58 | |
| +862156762820 +86-13564624040 |
China | 7707 | 58 | |
| +86-27-87465837 +8618971612321 |
China | 9639 | 58 | |
| 0952-9294929 +8613895679378 |
China | 352 | 58 | |
| +86-21-59960785 +86-17701845089 |
China | 338 | 58 | |
| +86-0311-87836622 +86-17333973358 |
China | 8051 | 58 |