碳酸锰
Manganesecarbonate
34156-69-9
34156-69-9
¥189
1KG
起订
广东 更新日期:2025-11-25
产品详情:
公司简介
佛山晟熠生物科技有限公司是一家 主要以化学合成化工原料、化工防腐、香精香料、食品添加剂等多类产品集研发、生产、经营、销售为一体的大型综合性高科技企业。
公司投入巨资和人力用于研发适应市场需求的精细化工,生物化工,医药中间体等新产品,新工艺。高水平的研发团队,一流的实验设备,良好的科研氛围保证了研发实力,目前生产的产品,全部由本公司自行研究开发,达到了国内先进水平,部分产品达到国际先进水平。公司拥有多套液相色谱仪、气相色谱仪和紫外分光光度计等高效、高灵敏度的分析仪器,并已通过 ISO9001质量体系认证。 我司全体员工将不懈的努力,执着地追求卓越的质量和完美的品牌及企业形象,秉承“坦诚、勤奋、求
| 成立日期 | (8年) |
| 注册资本 | 200万 |
| 员工人数 | 10-50人 |
| 年营业额 | ¥ 1000万-5000万 |
| 经营模式 | 贸易 |
| 主营行业 | 中间体 |
碳酸锰相关厂家报价
-
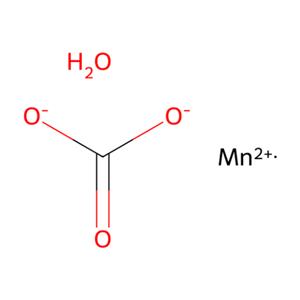
- aladdin 阿拉丁 M466608 碳酸锰(II)水合物 34156-69-9 Mn含量≥43.5%
- 上海阿拉丁生化科技股份有限公司 VIP
- 2025-11-25
- ¥249.90
-

- 碳酸锰 锰化合物原料 农业肥料 医药中间体 按需分装
- 中山市迪欣化工有限公司 VIP
- 2026-01-26
- 询价
-

- 碳酸锰 电焊条制造瓷釉涂料颜料 598-62-9
- 武汉吉业升化工有限公司 VIP
- 2026-01-26
- 询价
-

- 碳酸锰_碳酸亚锰_工业级 生产厂家 现货直发
- 广州远达新材料有限公司 VIP
- 2026-01-26
- 询价


