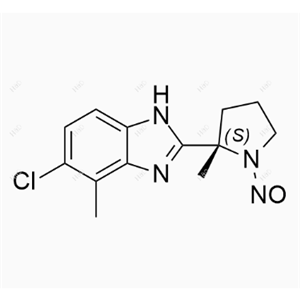
达利雷生亚硝基杂质17

联系方式:杜经理 TEL: 17320513646(微信同号) QQ: 2853567688
产品编号:D089017
英文名:Daridorexant Nitroso Impurity 17
英文别名:(S)-5-chloro-4-methyl-2-(2-methyl-1-nitrosopyrrolidin-2-yl)-1H-benzo [d] imidazole(注:核心结构含 (S)- 手性构型的 2 - 甲基吡咯烷环、1 - 亚硝基取代基、5 - 氯 - 4 - 甲基 - 1H - 苯并 [d] 咪唑母核,是达利雷生(双重食欲素受体拮抗剂)合成或储存过程中,吡咯烷环胺基发生亚硝化反应生成的基因毒性杂质,区别于达利雷生无亚硝基取代的吡咯烷环结构)
CAS 号:无
分子式:C13H15ClN4O
分子量:278.74
基因毒性杂质专属质控优势:纯度经 HPLC-MS/MS 与手性色谱双重验证,纯度≥98.5%,且基因毒性杂质专属检测方法下无干扰峰,明确含 (S)- 手性中心、亚硝基(-NO)、氯代苯并咪唑特征结构,与达利雷生主峰及普通工艺杂质分离度>2.0,可作为基因毒性杂质的专属对照品,满足 ICH M7 指导原则下的痕量质控需求。
稳定性适配基因毒性杂质检测场景:在避光、低温(2-8℃)、氮气保护密封储存条件下,亚硝基结构无分解或重排风险,(S)- 手性构型无消旋现象,可稳定保存 10 个月以上,能保障多批次痕量检测数据的重复性,适配达利雷生原料药及制剂的基因毒性杂质长期监控需求。
痕量检测兼容性优异:易溶于甲醇、乙腈、二甲基亚砜,可溶于乙腈 - 水(含 0.1% 甲酸)混合溶剂;通过超高效液相色谱 - 串联质谱(UPLC-MS/MS),以乙腈 - 醋酸铵缓冲液(pH 4.5)梯度洗脱,能实现 0.001 μg/mL 级别的痕量检出,远低于 ICH M7 规定的每日允许暴露量(PDE)限值,满足基因毒性杂质的高灵敏度检测要求。
基因毒性杂质监控核心场景:用于达利雷生原料药及片剂的质量控制,重点监测合成过程中原料带入或储存阶段胺基亚硝化生成的该杂质含量 —— 作为治疗失眠的双重食欲素受体拮抗剂,达利雷生需符合 ICH M7、EP、USP 对基因毒性杂质的严格限量要求(PDE 值通常<10 μg / 天),精准检测可避免因基因毒性杂质超标引发的用药安全风险。
合成与储存工艺优化参照:辅助排查杂质生成源头,例如达利雷生合成中吡咯烷胺基原料含亚硝酸盐杂质、反应体系接触含氮氧化物的氧化剂,或储存环境中光照 / 高温导致胺基亚硝化等问题,通过严控原料亚硝酸盐含量(<0.001%)、采用惰性气体保护合成体系、优化制剂包材避光性,可显著降低该杂质的生成量。
检测方法开发与验证:作为标准品用于 UPLC-MS/MS 基因毒性杂质检测方法的验证,确认方法的定量限(LOQ≤0.0005 μg/mL)、回收率(90%-110%)及基质效应(≤±10%);针对制剂辅料基质干扰,可采用同位素内标法(如氘代对照品),结合多反应监测(MRM)模式(监测 m/z 279.1→196.0 特征离子对),提升痕量检测的准确性与重复性。
达利雷生是 2022 年获批的新型失眠治疗药物,通过阻断食欲素 A/B 受体抑制觉醒信号,具有起效快、日间残留镇静作用低的优势,是临床治疗慢性失眠的一线药物。其核心结构含 (S)-2 - 甲基吡咯烷 - 2 - 基 - 苯并咪唑母核,而吡咯烷环上的仲胺基是典型的亚硝化反应位点。
达利雷生亚硝基杂质 17 是典型的基因毒性工艺与降解杂质:在合成环节,若吡咯烷胺基原料中混入亚硝酸盐,或反应体系引入硝酸、亚硝酸等氧化剂,仲胺基会发生亚硝化反应生成该杂质;在储存环节,制剂接触光照、高温或包装材料释放的氮氧化物,也会诱发胺基的亚硝化降解。由于该杂质具有潜在致突变性,且达利雷生临床用药周期较长,其痕量控制是保障用药安全的关键。
根据 ICH M7 指导原则,基因毒性杂质需控制在每日允许暴露量范围内,因此对该杂质的专属对照品研发与检测方法建立,是达利雷生药品合规上市与生命周期质量管理的核心环节。
检测技术成熟度:当前主流检测方法为 UPLC-MS/MS 多反应监测模式,采用 C18 色谱柱(如 Waters Acquity UPLC BEH C18),以乙腈 - 0.01 mol/L 醋酸铵缓冲液(pH 4.5)为流动相梯度洗脱,监测离子对 m/z 279.1([M+H]+)→196.0(失去亚硝基吡咯烷片段),定量限(LOQ)可达 0.0003 μg/mL,满足 ICH M7 对基因毒性杂质的痕量检测要求;手性拆分可采用 Chiralcel OJ-H 柱,实现 (S)- 构型与 (R)- 异构体的基线分离,避免手性异构杂质的干扰。
生成机制与控制策略:研究证实,该杂质生成量与 “亚硝酸盐浓度” 及 “储存条件” 直接相关 —— 原料中亚硝酸盐含量>0.0005% 时,合成环节杂质生成量会突破 PDE 限值;储存环境光照强度>2000 lx 或温度>25℃时,12 个月内杂质增幅可达 5 倍以上。工艺控制方向已明确为 “采用高纯度无亚硝酸盐的吡咯烷胺原料、合成体系通氮气除氧”,储存控制则需采用铝塑复合膜避光包装并控制仓储温度≤25℃。
安全性与标准进展:毒理学研究显示,该杂质具有 Ames 试验阳性致突变性,其 PDE 值经计算为 8.2 μg / 天;目前,EP、USP 在达利雷生质量标准中已将其列为重点监控的基因毒性杂质,明确了 UPLC-MS/MS 检测方法及限度(≤0.0002%);国内药监局也已要求进口及国产达利雷生制剂需提交该杂质的痕量控制数据,现有研究为基因毒性杂质的风险评估与质控提供了核心依据。
联系方式:杜经理 TEL: 17320513646(微信同号) QQ: 2853567688
备注:我们也可以定制相关类似物和修饰肽,提供包括高效液相色谱(HPLC)、质谱(MS)、核磁共振氢谱(1H-NMR)、质谱(MS)、高效液相色谱(HPLC)、红外光谱(IR)、紫外光谱(UV)、分析报告(COA)、物质安全数据表(MSDS)等资料。本产品仅用于实验室用途!