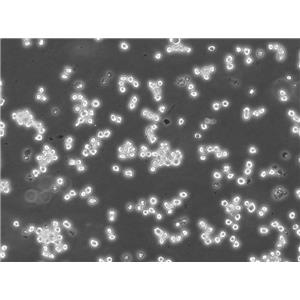
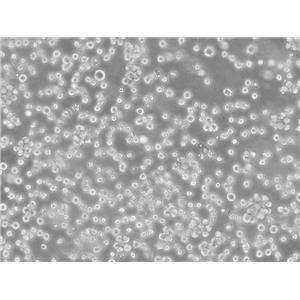
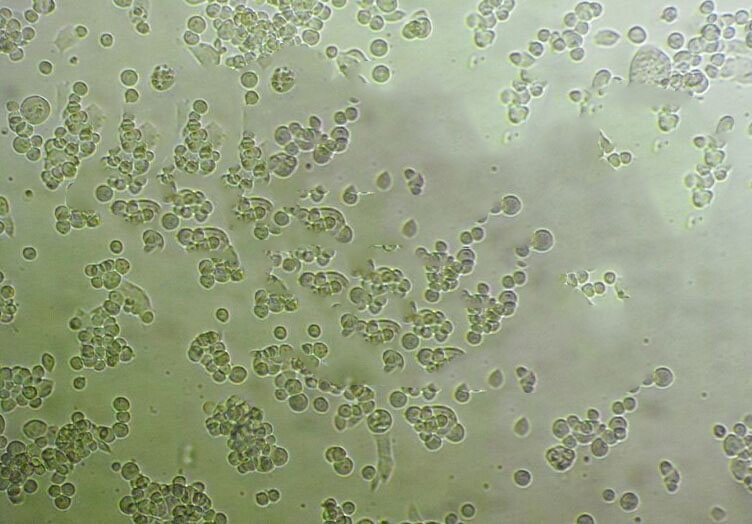
"U251人胶质瘤细胞全年复苏|已有STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:贴壁生长
细胞系的选择需要考虑到细胞系的功能特点、生长速率、铺板效率、生长条件和生长特征、克隆效率、培养方式等因素,如果您想高产量表达重组蛋白,您可以选择可以悬浮生长的快速生长细胞系。细胞培养的操作步骤主要包括传代、换液、冻存和复苏。这些步骤确保了细胞能够在实验室环境中长期存活并继续增殖。传代是将细胞从一个容器转移到另一个容器的过程,以扩大细胞数量;换液是为了清除代谢废物并补充新鲜培养基;冻存则是为了长期保存细胞,而复苏则是重新激活冷冻保存的细胞使其恢复正常生长。
换液周期:每周2-3次
COV434 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:SRS-82细胞、NWA细胞、FL83B细胞
BEL-7402 Cells;背景说明:BEL-7402细胞株是1974年从临床肝癌手术标本中建立的。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:5-8F细胞、P-36细胞、Epithelioma Papulosum Cyprini细胞
SUM190 Cells;背景说明:乳腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SW 780细胞、JURKAT E-61细胞、SCC15细胞
背景信息:最初是从一名患有恶性胶质瘤的患者的脑组织中分离并培养的。是一种人胶质瘤细胞系,表达多种胶质瘤标志蛋白,如胶质纤维酸性蛋白(GFAP)、巢蛋白(Nestin)、神经细胞黏附分子(NCAM)和SALL4。
U251人胶质瘤细胞全年复苏|已有STR图谱
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
ATCC细胞库(American Type Culture Colection),该中心一直致力于细胞分类、鉴定和保藏工作。ATCC是全球最大的生物资源保藏中心,ATCC通过行业标准产品、服务和创新解决方案支持全球学术、政府、生物技术、制药、食品、农业和工业领域的科学进步。ATCC提供的服务和定制解决方案包括细胞和微生物培养、鉴定、生物衍生物的开发和生产、性能测试和生物资源保藏服务。美国国家标准协会(ANSI)认可了ATCC标准开发组织,并制定了标准协议,以确保生物材料的可靠性和可重复性。ATCC的使命是为了获取、鉴定、保存、开发、标准化和分发生物资源和生物信息,以提高和应用生物科学知识。
7860 Cells;背景说明:该细胞源自一位原发性肾透明细胞癌患者。该细胞有微绒毛和桥粒,能在软琼脂上生长。此细胞生成一种PTH(甲状旁腺素)样的多肽,与乳癌和肺癌中生成的肽相似,其N端序列与PTH相似,具有PTH样活性,分子量为6000D。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HPAF II细胞、IMR90细胞、RS411细胞
U118MG Cells;背景说明:注意: 据报道来自不同个体的胶质母细胞瘤细胞株U-118 MG (HTB-15) 和 U-138 MG (HTB-16)有着一致的VNTR和相近的STR模式。 U-118 MG 和 U-138 MG细胞遗传学上很相似并有至少六个衍生标记染色体。 这是1966年至1969年间J. Ponten和同事从恶性神经胶质瘤中构建的细胞株中的一株(其它包括ATCC HTB-14和 ATCC HTB-16 and ATCC HTB-17)。 1987年用BM-Cycline培养6周去除了支原体污染。 ;传代方法: 消化3-5分钟。1:2传代。3天内可长满。;生长特性:贴壁生长;形态特性:混合型;相关产品有:NCI-H2141细胞、TCCSUP细胞、SNU-878细胞
GB1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:COLO 680N细胞、HL1细胞、rUCMSCs细胞
6F7 [Mouse hybridoma against Ebola virus VP35] Cells(提供STR鉴定图谱)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
物种来源:人源、鼠源等其它物种来源
U251人胶质瘤细胞全年复苏|已有STR图谱
形态特性:成纤维细胞样
贴壁细胞的消化方法介绍:1、胰酶。这是用得Zui多的。一般浓度在0.25-0.5%。作用时间根据细胞种类、作用温度等因素而变化很大,从几分钟到几十分钟不等。0.25%的胰酶作用于单层贴壁的细胞,在37度条件下,一般消化1-5分钟就足够了。终止是用血清。主要作用于细胞间。配制时不能用含、镁的平衡,否则影响活性。保存于-20度。2、胶原酶。这种方法比较少,一般是用原代培养时,从组织消化下细胞。这种方法作用温和,对细胞损伤较小,但是,价格也较贵。中止同样是用血清。3、EDA。用得也是非常多。一般浓度在0.02%左右。作用于细胞与间质,对细胞间也有一定作用。注意,它能显著影响pH值,而且在弱碱性条件下才易溶。因此,配制时应调节HAO碱度。它不能被终和。因此,消化下来的细胞要洗一遍。4、商品化的无酶消化。个人的使用经常觉得对细胞的损伤比较大,但是分离成单细胞悬的能力确实比较强。5、物理法。直接吹打或用细胞刮子将细胞刮下来。6、冷冻法。此方法仅能用于细胞传代时。无法使组织上的细胞脱落下来。本方法的原理,我想是因细胞冷冻后收缩,从而从培养瓶上脱落下来。YOU点是:对细胞损伤小,不需要中止或洗细胞,方便,不需要另外配制消化。别适用那些贴壁不是别紧,又别娇气的细胞。不足是细胞常成小片脱落。此种方法曾用于因用其它方法传代导致大量细胞死亡操作的间充质干细胞、DC细胞的培养,效果非常满意。具体过程是:1、用较多的4度的PBS 洗涤一遍细胞(以6孔板为例,加1.5ml/孔),2、再加0.5毫升4度的PBS,静置操作台上,很快细胞就小片脱落,3、轻轻吹打,细胞即完全脱落,4、按一定比例传代。
Line 522 Cells;背景说明:肺腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H4IIEC3细胞、F442-A细胞、hMSC-BM细胞
LLC-MK2 Cells;背景说明:胚胎;肾;自发永生;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Primary Liver Carcinoma/Poliomyelitis Research Foundation/5细胞、PC3细胞、L-M (TK-)细胞
Super Tube Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SCCVII/St细胞、COR-L23/P细胞、TE5细胞
HSAS1 Cells;背景说明:皮肤成纤维 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:hEM15A细胞、NSH细胞、rHSC-99细胞
DU145 Cells;背景说明:DU 145 是从一位有3年淋巴细胞白血病史的前列腺癌患者的脑部转移灶中建立的。该细胞系未检测到激素敏感性,酸性酶阳性,单个的细胞可在软琼脂中形成集落。对此细胞和原始肿瘤的亚显微结构分析可见微绒毛、微丝、细胞桥粒、线粒体、发达的高尔基体和异质溶酶体。该细胞不表达前列腺抗原。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:RKN细胞、Mc Coy细胞、1.1B4细胞
NCI-H1869 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;每周换液2次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:LS-1034细胞、ssMCF7细胞、TGHAVSMC细胞
RD-ES Cells;背景说明:详见相关文献介绍;传代方法:1:8传代:每周换液2-3次;生长特性:贴壁和悬浮混合;形态特性:上皮样;相关产品有:BSC1细胞、H-810细胞、OCI-AML-4细胞
MES 13 Cells;背景说明:肾小球系膜;SV40转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MCA38细胞、HLEB-3细胞、SUM 149PT细胞
CCRF Cells;背景说明:G.E. Foley 等人建立了类淋巴母细胞细胞株CCRF-CEM。 细胞是1964年11月从一位四岁白人女性急性淋巴细胞白血病患者的外周血白血球衣中得到。此细胞系从香港收集而来。;传代方法:1:2传代。3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞样;相关产品有:EC9706细胞、SP2/0 Ag-14细胞、EA hy 926细胞
OACP4C Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:B-cell Acute Lymphoblastic Leukemia-1细胞、EOC 20细胞、NB-4细胞
KU-812F Cells;背景说明:慢性粒细胞白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:E304细胞、LAN-6细胞、BpRc1细胞
P3/NS1/1-Ag4-1 Cells;背景说明:这是P3X63Ag8(ATCCTIB-9)的一个不分泌克隆。Kappa链合成了但不分泌。能抗0.1mM8-氮杂鸟嘌呤但不能在HAT培养基中生长。据报道它是由于缺失了3-酮类固醇还原酶活性的胆固醇营养缺陷型。检测表明肢骨发育畸形病毒(鼠痘)阴性。;传代方法:1:2传代,3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:EU-3细胞、GM 2132细胞、SHP-77细胞
MDAMB468 Cells;背景说明:该细胞是1977年由CailleauR等从一位患有转移性乳腺癌的51岁黑人女性的胸腔积液中分离得到的。虽然供体组织的G6PD等位基因杂合,但此细胞株始终表现为G6PDA表型。P53基因273位密码子存在G→A突变,从而导致Arg→His替代。每个细胞上存在1×106个EGF受体。;传代方法:1:2-1:4传代;2-3天换液1次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HT1080细胞、BC-023细胞、IM9细胞
BT20 Cells;背景说明:该细胞1958年由E.Y. Lasfargues 和 L. Ozzello 建系,源自一位74岁白人女性的乳腺癌组织。该细胞表达WNT3和WNT78。TNF alpha抑制该细胞生长。该细胞雌激素受体阴性,但表达5'外显子缺失的雌激素mRNA。;传代方法:1:2—1:4传代,2—3天换液一次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:OV-90细胞、MDAMB361细胞、PANC-04-03细胞
H820 Cells;背景说明:乳头状肺腺癌;淋巴结转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CHP-100细胞、PC 61细胞、IAR-20细胞
SCL-2 Cells;背景说明:皮肤鳞癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:BNCL-2细胞、LNCaP subline C4-2细胞、PIG3细胞
EC-109 Cells;背景说明:1973年建系,来自人食管中段鳞癌组织,小块法原代培养建系。BALB/c裸鼠移植成瘤。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:HRIF细胞、P3-X63Ag8.653细胞、SUDHL-1细胞
156 BLCL Cells(提供STR鉴定图谱)
Abcam HeLa H1-2 KO Cells(提供STR鉴定图谱)
AG22042 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRF308 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XG518 Cells(提供STR鉴定图谱)
C073 Cells(提供STR鉴定图谱)
CW60164 Cells(提供STR鉴定图谱)
DT40(v-myb)delta-pol-beta Cells(提供STR鉴定图谱)
GM03905 Cells(提供STR鉴定图谱)
SR786 Cells;背景说明:间变性大细胞淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:NOR-10细胞、NCIH1944细胞、639-V细胞
Hs-274-T Cells;背景说明:详见相关文献介绍;传代方法:1:2传代,每周换液2-3次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:GI-1细胞、HeLa S-3细胞、Pfeiffer细胞
X63-AG 8.653 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:LAN-5细胞、OVCAR433细胞、H-157细胞
HLFa Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代;每周换液2次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:H1563细胞、SNU-398细胞、H2196细胞
CTV-1 Cells;背景说明:急性T淋巴细胞白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:P3/NS1/Ag4-1细胞、T-98G细胞、FLS细胞
NCI N87 Cells;背景说明:NCI-N87细胞表达表面糖蛋白癌胚抗原(CEA)和TAG72,并且没有左旋多巴胺脱羧酶(DDC)活性。它们的血管活性的肠肽(VIP)受体活性极低并缺乏胃泌激素受体。它们表达蕈毒碱胆碱受体。没有证据表明存在N-myc,L-myc,myb和EGF受体基因的重组。这个细胞株表达的c-myc和c-erb-B2RNA水平与其它细胞株相当。以下基因不表达:N-myc,L-myc,c-cis,IGF-2,或胃泌激素释放肽。报道NCI-N87细胞的植板率为4.3%。;传代方法:消化15-20分钟。1:2。4-5天长满。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:MGC-803细胞、MV4-11细胞、NCIH208细胞
Hs 766 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:8传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:SUM52PE细胞、A172细胞、HF-91细胞
MDA-PCa-2b Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:H-2110细胞、HT144mel细胞、MLMEC细胞
U251人胶质瘤细胞全年复苏|已有STR图谱
BE(2)-C Cells;背景说明:神经母细胞瘤;骨髓转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H209细胞、MESSA/Dx5细胞、COLO679细胞
HEP-3B2 Cells;背景说明:肝癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CNE-2Z细胞、OCLY8细胞、KMM-1细胞
Hs 578T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SK-N-AS细胞、F98细胞、WM 239-A细胞
A375S2 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:H1341细胞、PANC 1005细胞、PNT1-a细胞
H-660 Cells;背景说明:详见相关文献介绍;传代方法:2-3天换液1次。;生长特性:悬浮生长;形态特性:上皮细胞;相关产品有:P3X63细胞、WM266mel细胞、Y3-Ag123细胞
H1563 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;每周换液2次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:GM00346细胞、T98细胞、MT2细胞
HT-29 Cells;背景说明:该细胞是1964年由FoghJ用移植培养方法和含15%FBS的F12培养液从原发性肿瘤分离的。近来,已建株的培养细胞用含血清的McCoy's5a培养基培养。该细胞系在裸鼠中成瘤,也能在类固醇处理的地鼠中成瘤。该细胞可合成IgA、CEA、TGFβ结合蛋白和黏液素;表达尿激酶受体,但没有检测到血浆酶原活性;不表达CD4,但细胞表面表达半乳糖神经酰胺(HIV的可能替代受体)。该细胞系癌基因c-myc、K-ras、H-ras、N-ras、Myb、sis、fos阳性;p53基因过表达,并且在273位密码子处发;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HS578细胞、HBL-1 [Human diffuse large B-cell lymphoma]细胞、HcerEpic细胞
GM17567 Cells(提供STR鉴定图谱)
HAP1 HPS1 (-) 1 Cells(提供STR鉴定图谱)
NP69 Cells;背景说明:鼻咽;上皮细胞;SV40转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H-2023细胞、LM(TK-)细胞、NCI-H1573细胞
Jurkat E6.1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-1869细胞、H2291细胞、NCI522细胞
AN3 CA Cells;背景说明:AN3CA细胞建系于1964年。它衍生于子宫内膜癌患者淋巴结转移组织,具有癌细胞的基本特性,能在体外长期传代培养,接种实验动物产生明显肿瘤。但细胞的生物学特性及超微结构尚未深入研究,仅发现该细胞系促黑激素合成为阴性。细胞常用于人子宫内膜癌细胞生物学及其相关特性研究。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:BV-2细胞、Ishikawa细胞、COLO 679细胞
FCCH1024 Cells;背景说明:该细胞源自一位14岁患有T淋巴细胞白血病男性的外周血;传代方法:保持细胞密度在3—9×105cells/ml之间,1:5—1:10传代,每周换液2—3次;生长特性:悬浮生长;形态特性:圆形,单个或呈片;相关产品有:751-NA细胞、KBM-7细胞、Emory University-3细胞
TO175T Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:CMT167细胞、U-343 MG细胞、LM TK negative细胞
MDA-MB-231-GFP Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:EJ细胞、LuCL4细胞、BTI-Tn-5B1-4细胞
Hep-3B Cells;背景说明:肝癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Hs445细胞、T24细胞、HOS/MNNG细胞
ST Cells;背景说明:ST细胞系建系于1960年(Mcclurkin,AW,etal)。ST细胞一般用于病毒增殖和分离,是猪细小病毒的理想宿主,可用于这类病毒的分离及增殖。;传代方法:1:3传代,2-3天传一代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:HGF-1细胞、THPI细胞、RGM-1细胞
HPS0133 Cells(提供STR鉴定图谱)
JHU146i Cells(提供STR鉴定图谱)
MD901 Cells(提供STR鉴定图谱)
ND32758 Cells(提供STR鉴定图谱)
PR01162 Cells(提供STR鉴定图谱)
TmB Cells(提供STR鉴定图谱)
UCT0234 Cells(提供STR鉴定图谱)
HB1.F3.Ngn1 Cells(提供STR鉴定图谱)
MES 23.5 Cells;背景说明:多巴胺能神经元 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:C2A细胞、Mono Mac6细胞、P3/ag细胞
HT29 Cells;背景说明:该细胞是1964年由FoghJ用移植培养方法和含15%FBS的F12培养液从原发性肿瘤分离的。近来,已建株的培养细胞用含血清的McCoy's5a培养基培养。该细胞系在裸鼠中成瘤,也能在类固醇处理的地鼠中成瘤。该细胞可合成IgA、CEA、TGFβ结合蛋白和黏液素;表达尿激酶受体,但没有检测到血浆酶原活性;不表达CD4,但细胞表面表达半乳糖神经酰胺(HIV的可能替代受体)。该细胞系癌基因c-myc、K-ras、H-ras、N-ras、Myb、sis、fos阳性;p53基因过表达,并且在273位密码子处发;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SW 962细胞、OVCA-432细胞、HCT_116细胞
X63-Ag8 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H187细胞、SW 1783细胞、H1930细胞
L1210 Cells;背景说明:该细胞源于用0.2%甲基胆蒽(溶解)涂抹雌性小鼠的皮肤诱发的肿瘤,鼠痘病毒阴性。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;相关产品有:HCA-7细胞、SVG p12细胞、TE9细胞
HT1197 Cells;背景说明:详见相关文献介绍;传代方法:1:5-1:10传代,2天换液1次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:190PT细胞、MKN1细胞、A-375细胞
HT1197 Cells;背景说明:详见相关文献介绍;传代方法:1:5-1:10传代,2天换液1次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:190PT细胞、MKN1细胞、A-375细胞
KG1 Cells;背景说明:详见相关文献介绍;传代方法:1:3传代,2-3天传一代;生长特性:悬浮生长;形态特性:原粒细胞;相关产品有:BE2M17细胞、U-87MG ATCC细胞、Hs 766T细胞
SNU1040 Cells;背景说明:结肠癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:16HBE14o-细胞、PLA-801D细胞、RSC 96细胞
TE 32.T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,3-4天换液1次。;生长特性:贴壁生长;形态特性:梭型和大的多核细胞;相关产品有:SF 767细胞、WEHI-3B细胞、C1498细胞
WSU-DLCL-2 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:UWB1.289+BRCA1细胞、MuM-2C细胞、H.Ep.-2细胞
hSCC-25 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:10传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:SF 295细胞、K1735细胞、HDF-a细胞
HT-144 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:8传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:RMC-1细胞、SU-DH-L5细胞、Line 522细胞
HCC-1833 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Menschliche Und Tierische Zellkulture-1细胞、Panc 5.04细胞、HOCF细胞
SR786 Cells;背景说明:间变性大细胞淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:NOR-10细胞、NCIH1944细胞、639-V细胞
HT-22 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:HCC 70细胞、Lewis lung carcinoma line 1细胞、Walker 256细胞
SKI-DLCL-1 Cells(提供STR鉴定图谱)
OCI-Ly07 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:MDA-175细胞、Nthy-ori 3-1细胞、U118MG细胞
H-378 Cells;背景说明:小细胞肺癌;胸腔积液转移;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SW839细胞、NCI-H87细胞、Alpha Mouse Liver 12细胞
Strain KB Cells;背景说明:最初认为这个细胞源自口腔表皮癌,但随后通过同工酶分析、HeLa标记染色体和DNA指纹分析发现,起源细胞已被HeLa污染。 角蛋白免疫过氧化物酶染色阳性。 有报告称KB细胞含有人乳头状瘤病毒18 (HPV-18)序列。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:上皮细胞样;相关产品有:6-T CEM细胞、RPMI 8226细胞、H-1792细胞
LL/2 (LLC1) Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HeLa229细胞、ROS 17/2.8细胞、LAN6细胞
A549-Taxol Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MLM细胞、KYSE410细胞、LNCaP-Clone-FGC细胞
SKNBE2 Cells;背景说明:1972年11月从一们多次化疗及放疗的扩散性神经母细胞瘤患儿骨髓穿刺物中建立了SK-N-BE(2)神经母细胞瘤细胞株。 该细胞显示中等水平的多巴胺-β-羟基酶活性。 有报道称SK-N-BE(2)细胞的饱和浓度超过1x106细胞/平方厘米。细胞形态多样,有的有长突触,有的呈上皮细胞样。 细胞会聚集,形成团块并浮起;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:PGBE1细胞、C26细胞、DHL-2细胞
PK-13 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:4传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:PG-BE1细胞、NCI H747细胞、EBNA-293细胞
WRL 68 Cells;背景说明:胚胎;肝 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:RAT2细胞、LIXC002细胞、U 138 MG细胞
U251人胶质瘤细胞全年复苏|已有STR图谱
ROS 17/28 Cells;背景说明:骨肉瘤;ACI 9935;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:A-427细胞、BpRcl细胞、Ly19细胞
H2342 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:6传代 ;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HGE细胞、HCa/16A3-F细胞、Dysplastic Oral Keratinocyte细胞
NCI-H1792 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:8传代。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:MA 104细胞、HOS-TE85细胞、CNLMG-B5537SKIN细胞
HPAF II Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:MD Anderson-Metastatic Breast-134-VI细胞、NRK clone 52E细胞、CA 46细胞
95C Cells;背景说明:肺巨细胞癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:PT-K75细胞、NPC-TW039细胞、X63-Ag8-653细胞
LTEP-sm 1 Cells;背景说明:小细胞肺癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HOCF细胞、Panc 5.04细胞、TE-85细胞
BayGenomics ES cell line CSJ200 Cells(提供STR鉴定图谱)
BayGenomics ES cell line TEA050 Cells(提供STR鉴定图谱)
CCRC-M133 Cells(提供STR鉴定图谱)
M15 9F11.1 Cells(提供STR鉴定图谱)
RIF/Ptr1 Cells(提供STR鉴定图谱)
SD-Tg.EC2 Cells(提供STR鉴定图谱)
" "PubMed=608846; DOI=10.1111/j.1601-5223.1978.tb01267.x
Mark J., Westermark B., Ponten J., Hugosson R.
Banding patterns in human glioma cell lines.
Hereditas 87:243-260(1977)
PubMed=833871; DOI=10.1093/jnci/58.2.209
Fogh J., Wright W.C., Loveless J.D.
Absence of HeLa cell contamination in 169 cell lines derived from human tumors.
J. Natl. Cancer Inst. 58:209-214(1977)
PubMed=77569; DOI=10.1111/j.1399-0039.1978.tb01259.x
Espmark J.A., Ahlqvist-Roth L., Sarne L., Persson A.
Tissue typing of cells in culture. III. HLA antigens of established human cell lines. Attempts at typing by the mixed hemadsorption technique.
Tissue Antigens 11:279-286(1978)
PubMed=450131; DOI=10.1038/279797a0
Day R.S. 3rd, Ziolkowski C.H.J.
Human brain tumour cell strains with deficient host-cell reactivation of N-methyl-N'-nitro-N-nitrosoguanidine-damaged adenovirus 5.
Nature 279:797-799(1979)
PubMed=6260907; DOI=10.1097/00005072-198105000-00001
Bigner D.D., Bigner S.H., Ponten J., Westermark B., Mahaley M.S. Jr., Ruoslahti E., Herschman H.R., Eng L.F., Wikstrand C.J.
Heterogeneity of genotypic and phenotypic characteristics of fifteen permanent cell lines derived from human gliomas.
J. Neuropathol. Exp. Neurol. 40:201-229(1981)
PubMed=6582512; DOI=10.1073/pnas.81.2.568; PMCID=PMC344720
Mattes M.J., Cordon-Cardo C., Lewis J.L. Jr., Old L.J., Lloyd K.O.
Cell surface antigens of human ovarian and endometrial carcinoma defined by mouse monoclonal antibodies.
Proc. Natl. Acad. Sci. U.S.A. 81:568-572(1984)
PubMed=3518877; DOI=10.3109/07357908609038260
Fogh J.
Human tumor lines for cancer research.
Cancer Invest. 4:157-184(1986)
PubMed=3675803
Bigner S.H., Bjerkvig R., Laerum O.D., Muhlbaier L.H., Bigner D.D.
DNA content and chromosomes in permanent cultured cell lines derived from malignant human gliomas.
Anal. Quant. Cytol. Histol. 9:435-444(1987)
PubMed=3335022
Alley M.C., Scudiero D.A., Monks A., Hursey M.L., Czerwinski M.J., Fine D.L., Abbott B.J., Mayo J.G., Shoemaker R.H., Boyd M.R.
Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay.
Cancer Res. 48:589-601(1988)
PubMed=2041050; DOI=10.1093/jnci/83.11.757
Monks A., Scudiero D.A., Skehan P., Shoemaker R.H., Paull K.D., Vistica D.T., Hose C.D., Langley J., Cronise P., Vaigro-Wolff A., Gray-Goodrich M., Campbell H., Mayo J.G., Boyd M.R.
Feasibility of a high-flux anticancer drug screen using a diverse panel of cultured human tumor cell lines.
J. Natl. Cancer Inst. 83:757-766(1991)
PubMed=7693337
Li H., Hamou M.-F., de Tribolet N., Jaufeerally R., Hofmann M., Diserens A.-C., Van Meir E.G.
Variant CD44 adhesion molecules are expressed in human brain metastases but not in glioblastomas.
Cancer Res. 53:5345-5349(1993)
PubMed=7763724
Satoh M., Takeuchi M.
Cross-contamination of cell lines as revealed by DNA fingerprinting in the IFO animal cell bank.
Res. Commun. Inst. Ferment. 16:18-23(1993)
PubMed=8104691
Pershouse M.A., Stubblefield E., Hadi A., Killary A.M., Yung W.-K.A., Steck P.A.
Analysis of the functional role of chromosome 10 loss in human glioblastomas.
Cancer Res. 53:5043-5050(1993)
DOI=10.1016/B978-0-12-333530-2.50005-8
Nister M., Westermark B.
Human glioma cell lines.
(In book chapter) Atlas of human tumor cell lines; Hay R.J., Park J.-G., Gazdar A.F. (eds.); pp.17-42; Academic Press; New York; USA (1994)
PubMed=8878451; DOI=10.1111/j.1349-7006.1996.tb02118.x; PMCID=PMC5921198
Zhang S., Endo S., Koga H., Ichikawa T., Feng X., Onda K., Washiyama K., Kumanishi T.
A comparative study of glioma cell lines for p16, p15, p53 and p21 gene alterations.
Jpn. J. Cancer Res. 87:900-907(1996)
PubMed=9090379; DOI=10.1038/ng0497-356
Steck P.A., Pershouse M.A., Jasser S.A., Yung W.-K.A., Lin H., Ligon A.H., Langford L.A., Baumgard M.L., Hattier T., Davis T., Frye C., Hu R., Swedlund B., Teng D.H.-F., Tavtigian S.V.
Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers.
Nat. Genet. 15:356-362(1997)
PubMed=9220028; DOI=10.1016/S0303-7207(97)00080-4
Sharif T.R., Luo W., Sharif M.
Functional expression of bombesin receptor in most adult and pediatric human glioblastoma cell lines; role in mitogenesis and in stimulating the mitogen-activated protein kinase pathway.
Mol. Cell. Endocrinol. 130:119-130(1997)
PubMed=9230885; DOI=10.1093/jnci/89.14.1036
Gomez-Manzano C., Fueyo J., Kyritsis A.P., McDonnell T.J., Steck P.A., Levin V.A., Yung W.-K.A.
Characterization of p53 and p21 functional interactions in glioma cells en route to apoptosis.
J. Natl. Cancer Inst. 89:1036-1044(1997)
PubMed=9614553; DOI=10.1038/sj.gt.3300605
Tada M., Sakuma S., Iggo R.D., Saya H., Sawamura Y., Fujiwara T., Roth J.A.
Monitoring adenoviral p53 transduction efficiency by yeast functional assay.
Gene Ther. 5:339-344(1998)
PubMed=9842975; DOI=10.1002/(SICI)1097-0215(19981218)79:6<640::aid-ijc15>3.0.CO;2-z
Weller M., Rieger J., Grimmel C., Van Meir E.G., De Tribolet N., Krajewski S., Reed J.C., von Deimling A., Dichgans J.
Predicting chemoresistance in human malignant glioma cells: the role of molecular genetic analyses.
Int. J. Cancer 79:640-644(1998)
DOI=10.1007/0-306-46861-1_11
Ali-Osman F.
Brain tumors.
(In book chapter) Human cell culture. Vol. 2. Cancer cell lines part 2; Masters J.R.W., Palsson B.O. (eds.); pp.167-184; Kluwer Academic Publishers; New York; USA (1999)
PubMed=10416987; DOI=10.1111/j.1750-3639.1999.tb00536.x; PMCID=PMC8098486
Ishii N., Maier D., Merlo A., Tada M., Sawamura Y., Diserens A.-C., Van Meir E.G.
Frequent co-alterations of TP53, p16/CDKN2A, p14ARF, PTEN tumor suppressor genes in human glioma cell lines.
Brain Pathol. 9:469-479(1999)
PubMed=10551321; DOI=10.1111/j.1349-7006.1999.tb00838.x; PMCID=PMC5926156
Zhang S.-J., Endo S., Ichikawa T., Yoshimura J., Onda K., Tanaka R., Washiyama K., Kumanishi T.
Rare-type mutations of MMAC1 tumor suppressor gene in human glioma cell lines and their tumors of origin.
Jpn. J. Cancer Res. 90:934-941(1999)
PubMed=10560660; DOI=10.1097/00005072-199911000-00007
Schmidt E.E., Ichimura K., Goike H.M., Moshref A., Liu L., Collins V.P.
Mutational profile of the PTEN gene in primary human astrocytic tumors and cultivated xenografts.
J. Neuropathol. Exp. Neurol. 58:1170-1183(1999)
PubMed=10700174; DOI=10.1038/73432
Ross D.T., Scherf U., Eisen M.B., Perou C.M., Rees C., Spellman P.T., Iyer V.R., Jeffrey S.S., van de Rijn M., Waltham M.C., Pergamenschikov A., Lee J.C.F., Lashkari D., Shalon D., Myers T.G., Weinstein J.N., Botstein D., Brown P.O.
Systematic variation in gene expression patterns in human cancer cell lines.
Nat. Genet. 24:227-235(2000)
PubMed=14614447; DOI=10.1038/sj.onc.1207198
Wischhusen J., Naumann U., Ohgaki H., Rastinejad F., Weller M.
CP-31398, a novel p53-stabilizing agent, induces p53-dependent and p53-independent glioma cell death.
Oncogene 22:8233-8245(2003)
PubMed=14655754; DOI=10.1111/j.1750-3639.2003.tb00479.x; PMCID=PMC8095903
Bahr O., Rieger J., Duffner F., Meyermann R., Weller M., Wick W.
P-glycoprotein and multidrug resistance-associated protein mediate specific patterns of multidrug resistance in malignant glioma cell lines, but not in primary glioma cells.
Brain Pathol. 13:482-494(2003)
PubMed=15748285; DOI=10.1186/1479-5876-3-11; PMCID=PMC555742
Adams S., Robbins F.-M., Chen D., Wagage D., Holbeck S.L., Morse H.C. 3rd, Stroncek D., Marincola F.M.
HLA class I and II genotype of the NCI-60 cell lines.
J. Transl. Med. 3:11.1-11.8(2005)
PubMed=15900046; DOI=10.1093/jnci/dji133
Mashima T., Oh-hara T., Sato S., Mochizuki M., Sugimoto Y., Yamazaki K., Hamada J.-i., Tada M., Moriuchi T., Ishikawa Y., Kato Y., Tomoda H., Yamori T., Tsuruo T.
p53-defective tumors with a functional apoptosome-mediated pathway: a new therapeutic target.
J. Natl. Cancer Inst. 97:765-777(2005)
PubMed=16232199; DOI=10.1111/j.1349-7006.2005.00099.x; PMCID=PMC11159392
Saigusa K., Hashimoto N., Tsuda H., Yokoi S., Maruno M., Yoshimine T., Aoyagi M., Ohno K., Imoto I., Inazawa J.
Overexpressed Skp2 within 5p amplification detected by array-based comparative genomic hybridization is associated with poor prognosis of glioblastomas.
Cancer Sci. 96:676-683(2005)
PubMed=16391870; DOI=10.3892/or.15.2.463
Castigli E., Sciaccaluga M., Schiavoni G., Brozzi F., Fabiani R., Gorello P., Gianfranceschi G.L.
GL15 and U251 glioblastoma-derived human cell lines are peculiarly susceptible to induction of mitotic death by very low concentrations of okadaic acid.
Oncol. Rep. 15:463-470(2006)
PubMed=16697959; DOI=10.1016/j.ccr.2006.03.030
Lee J., Kotliarova S., Kotliarov Y., Li A.-G., Su Q., Donin N.M., Pastorino S., Purow B.W., Christopher N., Zhang W., Park J.K., Fine H.A.
Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines.
Cancer Cell 9:391-403(2006)
PubMed=17088437; DOI=10.1158/1535-7163.MCT-06-0433; PMCID=PMC2705832
Ikediobi O.N., Davies H.R., Bignell G.R., Edkins S., Stevens C., O'Meara S., Santarius T., Avis T., Barthorpe S., Brackenbury L., Buck G., Butler A.P., Clements J., Cole J., Dicks E., Forbes S., Gray K., Halliday K., Harrison R., Hills K., Hinton J., Hunter C., Jenkinson A., Jones D., Kosmidou V., Lugg R., Menzies A., Miroo T., Parker A., Perry J., Raine K.M., Richardson D., Shepherd R., Small A., Smith R., Solomon H., Stephens P.J., Teague J.W., Tofts C., Varian J., Webb T., West S., Widaa S., Yates A., Reinhold W.C., Weinstein J.N., Stratton M.R., Futreal P.A., Wooster R.
Mutation analysis of 24 known cancer genes in the NCI-60 cell line set.
Mol. Cancer Ther. 5:2606-2612(2006)
PubMed=17595512; DOI=10.1159/000104150
Rieger J., Frank B., Weller M., Wick W.
Mechanisms of resistance of human glioma cells to Apo2 ligand/TNF-related apoptosis-inducing ligand.
Cell. Physiol. Biochem. 20:23-34(2007)
PubMed=19372543; DOI=10.1158/1535-7163.MCT-08-0921; PMCID=PMC4020356
Lorenzi P.L., Reinhold W.C., Varma S., Hutchinson A.A., Pommier Y., Chanock S.J., Weinstein J.N.
DNA fingerprinting of the NCI-60 cell line panel.
Mol. Cancer Ther. 8:713-724(2009)
PubMed=19435942; DOI=10.1215/15228517-2009-025; PMCID=PMC2743214
Ichimura K., Pearson D.M., Kocialkowski S., Backlund L.M., Chan R., Jones D.T.W., Collins V.P.
IDH1 mutations are present in the majority of common adult gliomas but rare in primary glioblastomas.
Neuro-oncol. 11:341-347(2009)
PubMed=20215515; DOI=10.1158/0008-5472.CAN-09-3458; PMCID=PMC2881662
Rothenberg S.M., Mohapatra G., Rivera M.N., Winokur D., Greninger P., Nitta M., Sadow P.M., Sooriyakumar G., Brannigan B.W., Ulman M.J., Perera R.M., Wang R., Tam A., Ma X.-J., Erlander M., Sgroi D.C., Rocco J.W., Lingen M.W., Cohen E.E.W., Louis D.N., Settleman J., Haber D.A.
A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers.
Cancer Res. 70:2158-2164(2010)
PubMed=20593219; DOI=10.1007/s11060-010-0283-9
Blough M.D., Beauchamp D.C., Westgate M.R., Kelly J.J.P., Cairncross J.G.
Effect of aberrant p53 function on temozolomide sensitivity of glioma cell lines and brain tumor initiating cells from glioblastoma.
J. Neurooncol. 102:1-7(2011)
PubMed=22068913; DOI=10.1073/pnas.1111840108; PMCID=PMC3219108
Gillet J.-P., Calcagno A.M., Varma S., Marino M., Green L.J., Vora M.I., Patel C., Orina J.N., Eliseeva T.A., Singal V., Padmanabhan R., Davidson B., Ganapathi R., Sood A.K., Rueda B.R., Ambudkar S.V., Gottesman M.M.
Redefining the relevance of established cancer cell lines to the study of mechanisms of clinical anti-cancer drug resistance.
Proc. Natl. Acad. Sci. U.S.A. 108:18708-18713(2011)
PubMed=22336246; DOI=10.1016/j.bmc.2012.01.017
Kong D.-X., Yamori T.
JFCR39, a panel of 39 human cancer cell lines, and its application in the discovery and development of anticancer drugs.
Bioorg. Med. Chem. 20:1947-1951(2012)
PubMed=22347499; DOI=10.1371/journal.pone.0031628; PMCID=PMC3276511
Ruan X.-Y., Kocher J.-P.A., Pommier Y., Liu H.-F., Reinhold W.C.
Mass homozygotes accumulation in the NCI-60 cancer cell lines as compared to HapMap trios, and relation to fragile site location.
PLoS ONE 7:E31628-E31628(2012)
PubMed=22384151; DOI=10.1371/journal.pone.0032096; PMCID=PMC3285665
Lee J.-S., Kim Y.K., Kim H.J., Hajar S., Tan Y.L., Kang N.-Y., Ng S.H., Yoon C.N., Chang Y.-T.
Identification of cancer cell-line origins using fluorescence image-based phenomic screening.
PLoS ONE 7:E32096-E32096(2012)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=22570425; DOI=10.1093/neuonc/nos072; PMCID=PMC3367844
Bady P., Diserens A.-C., Castella V., Kalt S., Heinimann K., Hamou M.-F., Delorenzi M., Hegi M.E.
DNA fingerprinting of glioma cell lines and considerations on similarity measurements.
Neuro-oncol. 14:701-711(2012)
PubMed=22628656; DOI=10.1126/science.1218595; PMCID=PMC3526189
Jain M., Nilsson R., Sharma S., Madhusudhan N., Kitami T., Souza A.L., Kafri R., Kirschner M.W., Clish C.B., Mootha V.K.
Metabolite profiling identifies a key role for glycine in rapid cancer cell proliferation.
Science 336:1040-1044(2012)
PubMed=23856246; DOI=10.1158/0008-5472.CAN-12-3342; PMCID=PMC4893961
Abaan O.D., Polley E.C., Davis S.R., Zhu Y.-L.J., Bilke S., Walker R.L., Pineda M.A., Gindin Y., Jiang Y., Reinhold W.C., Holbeck S.L., Simon R.M., Doroshow J.H., Pommier Y., Meltzer P.S.
The exomes of the NCI-60 panel: a genomic resource for cancer biology and systems pharmacology.
Cancer Res. 73:4372-4382(2013)
PubMed=23933261; DOI=10.1016/j.celrep.2013.07.018
Moghaddas Gholami A., Hahne H., Wu Z.-X., Auer F.J., Meng C., Wilhelm M., Kuster B.
Global proteome analysis of the NCI-60 cell line panel.
Cell Rep. 4:609-620(2013)
PubMed=24279929; DOI=10.1186/2049-3002-1-20; PMCID=PMC4178206
Dolfi S.C., Chan L.L.-Y., Qiu J., Tedeschi P.M., Bertino J.R., Hirshfield K.M., Oltvai Z.N., Vazquez A.
The metabolic demands of cancer cells are coupled to their size and protein synthesis rates.
Cancer Metab. 1:20.1-20.13(2013)
PubMed=24670534; DOI=10.1371/journal.pone.0092047; PMCID=PMC3966786
Varma S., Pommier Y., Sunshine M., Weinstein J.N., Reinhold W.C.
High resolution copy number variation data in the NCI-60 cancer cell lines from whole genome microarrays accessible through CellMiner.
PLoS ONE 9:E92047-E92047(2014)
PubMed=24810477; DOI=10.1002/cam4.219; PMCID=PMC4303149
Torsvik A., Stieber D., Enger P.O., Golebiewska A., Molven A., Svendsen A., Westermark B., Niclou S.P., Olsen T.K., Chekenya Enger M., Bjerkvig R.
U-251 revisited: genetic drift and phenotypic consequences of long-term cultures of glioblastoma cells.
Cancer Med. 3:812-824(2014)
PubMed=25960936; DOI=10.4161/21624011.2014.954893; PMCID=PMC4355981
Boegel S., Lower M., Bukur T., Sahin U., Castle J.C.
A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines.
OncoImmunology 3:e954893.1-e954893.12(2014)
PubMed=25984343; DOI=10.1038/sdata.2014.35; PMCID=PMC4432652
Cowley G.S., Weir B.A., Vazquez F., Tamayo P., Scott J.A., Rusin S., East-Seletsky A., Ali L.D., Gerath W.F.J., Pantel S.E., Lizotte P.H., Jiang G.-Z., Hsiao J., Tsherniak A., Dwinell E., Aoyama S., Okamoto M., Harrington W., Gelfand E.T., Green T.M., Tomko M.J., Gopal S., Wong T.C., Li H.-B., Howell S., Stransky N., Liefeld T., Jang D., Bistline J., Meyers B.H., Armstrong S.A., Anderson K.C., Stegmaier K., Reich M., Pellman D., Boehm J.S., Mesirov J.P., Golub T.R., Root D.E., Hahn W.C.
Parallel genome-scale loss of function screens in 216 cancer cell lines for the identification of context-specific genetic dependencies.
Sci. Data 1:140035-140035(2014)
PubMed=25894527; DOI=10.1371/journal.pone.0121314; PMCID=PMC4404347
Bausch-Fluck D., Hofmann A., Bock T., Frei A.P., Cerciello F., Jacobs A., Moest H., Omasits U., Gundry R.L., Yoon C., Schiess R., Schmidt A., Mirkowska P., Hartlova A.S., Van Eyk J.E., Bourquin J.-P., Aebersold R., Boheler K.R., Zandstra P.W., Wollscheid B.
A mass spectrometric-derived cell surface protein atlas.
PLoS ONE 10:E0121314-E0121314(2015)
PubMed=27377824; DOI=10.1038/sdata.2016.52; PMCID=PMC4932877
Mestdagh P., Lefever S., Volders P.-J., Derveaux S., Hellemans J., Vandesompele J.
Long non-coding RNA expression profiling in the NCI60 cancer cell line panel using high-throughput RT-qPCR.
Sci. Data 3:160052-160052(2016)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=27582061; DOI=10.1126/scitranslmed.aaf6853
Allen M., Bjerke M., Edlund H., Nelander S., Westermark B.
Origin of the U87MG glioma cell line: good news and bad news.
Sci. Transl. Med. 8:354re3.1-354re3.4(2016)
PubMed=27807467; DOI=10.1186/s13100-016-0078-4; PMCID=PMC5087121
Zampella J.G., Rodic N., Yang W.R., Huang C.R.L., Welch J., Gnanakkan V.P., Cornish T.C., Boeke J.D., Burns K.H.
A map of mobile DNA insertions in the NCI-60 human cancer cell panel.
Mob. DNA 7:20.1-20.11(2016)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=29716531; DOI=10.1186/s12885-018-4394-6; PMCID=PMC5930953
Hegge B., Sjottem E., Mikkola I.
Generation of a PAX6 knockout glioblastoma cell line with changes in cell cycle distribution and sensitivity to oxidative stress.
BMC Cancer 18:496.1-496.19(2018)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=30971826; DOI=10.1038/s41586-019-1103-9
Behan F.M., Iorio F., Picco G., Goncalves E., Beaver C.M., Migliardi G., Santos R., Rao Y., Sassi F., Pinnelli M., Ansari R., Harper S., Jackson D.A., McRae R., Pooley R., Wilkinson P., van der Meer D.J., Dow D., Buser-Doepner C.A., Bertotti A., Trusolino L., Stronach E.A., Saez-Rodriguez J., Yusa K., Garnett M.J.
Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens.
Nature 568:511-516(2019)"