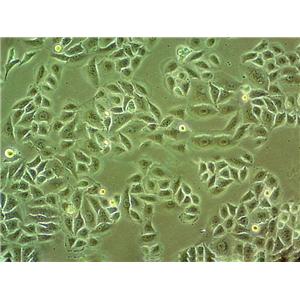
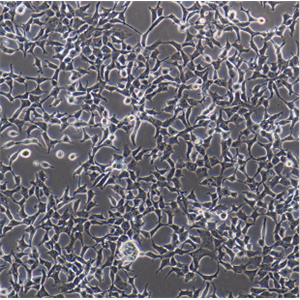
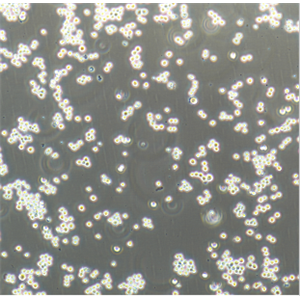
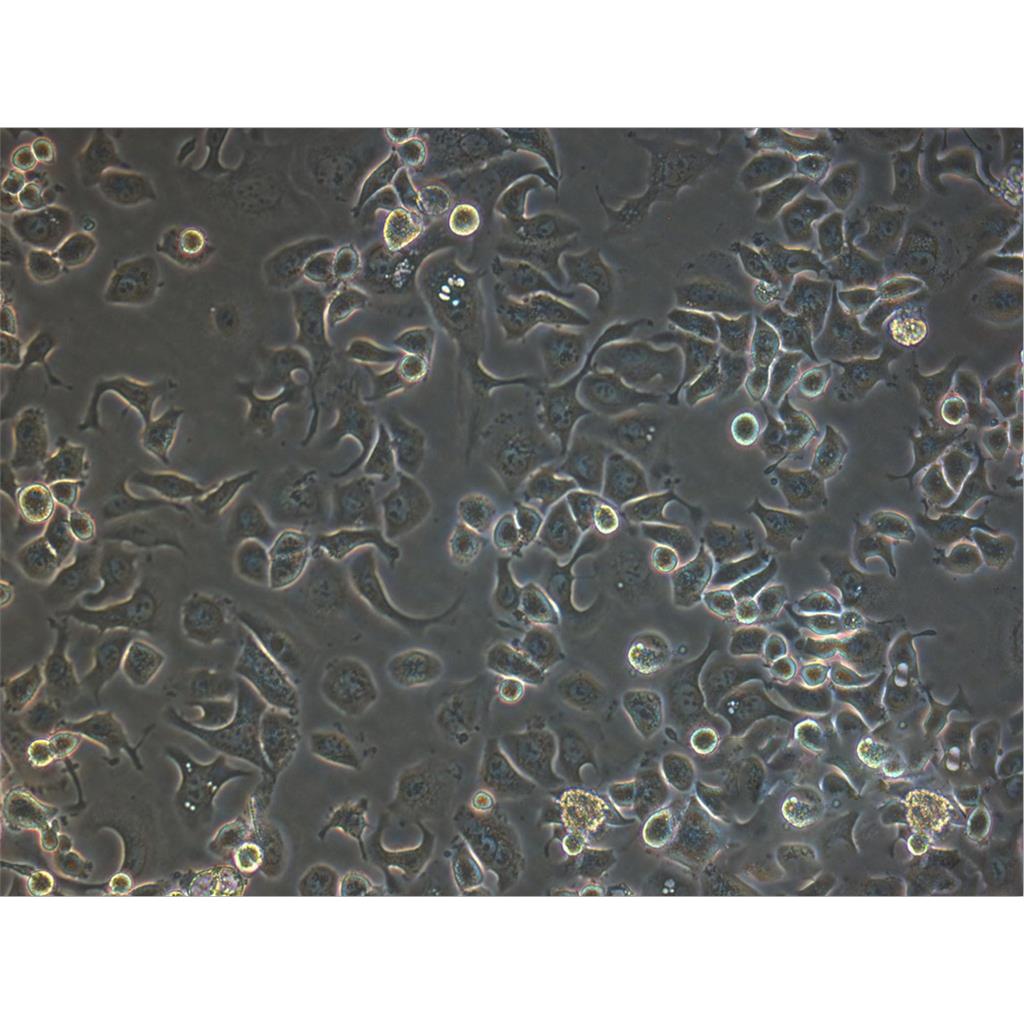
"MKN1人胃癌细胞代次低|培养基|送STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:贴壁生长
【细胞培养经验分享】启蒙老师的重要性:一般进实验室都有师兄师姐带着做,他们就是你做细胞的启蒙老师。他们的操作手法、细节、理论讲解就成了你操作的准则,如营养液、细胞瓶的摆放位置、灭菌处理程序、开盖手法、细胞吹打手法等等。要学会他们的正确操作,在第一次的时候就要重视。像养孩子一样养细胞,细胞有时真的很脆弱,最好每天都去看看它,以防止出现培养箱缺水、缺二氧化碳、停电、温度不够等异常现象,也好及时解决这些意外,避免重复实验带来的更大痛苦。好细胞要及时保种:细胞要分批传代,这样即使有一批出了问题,还有一批备用的。像后者一般人可能不容易做到。但这是我血的教训,有一次细胞污染了,全军覆没。当时可后悔没有保种。细胞跟人一样,不同的细胞,培养特性是不一样的。培养过程中要细细体会,不同细胞系使用不同的培养基和血清。
换液周期:每周2-3次
HemECs Cells;背景说明:血管瘤;内皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Beta-TC-6细胞、H-1184细胞、COS-7细胞
SVG(P12) Cells;背景说明:星形胶质细胞;SV40转化;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:BPH1细胞、NCI-SNU-886细胞、COLO320-DM细胞
OVCAR-3 Cells;背景说明:该细胞1982年由T.C. Hamilton等建系,源自一位60卵巢腺癌的腹水,是卵巢癌抗药性研究的模型。;传代方法:1:2—1:4传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:TE10细胞、SW1417细胞、LN-382细胞
MKN1人胃癌细胞代次低|培养基|送STR图谱
背景信息:详见相关文献介绍
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
细胞培养应用于分子生物学、细胞生物学、遗传学、免疫学、肿瘤学及病毒学等领域,细胞培养是指将细胞从动物或植物体内取出,然后在适宜的人工环境中生长的过程。细胞可以在培养前直接从组织中取出并通过酶或机械方法进行解离,也可以来源于已建立的细胞系。传代培养是指当细胞生长至高密度时,将其分殖至新的培养瓶中,以维持其生长和增殖。贴壁细胞是指在培养基表面附着生长的细胞,悬浮细胞是指在培养基中悬浮生长的细胞,不依附于培养皿表面。半贴壁半悬浮细胞同时具备贴壁细胞和悬浮细胞的特点,通常在培养基中部分附着生长,部分悬浮于培养基上。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
MKN1人胃癌细胞代次低|培养基|送STR图谱
物种来源:人源、鼠源等其它物种来源
HCC-1937 Cells;背景说明:这株细胞1995年10月13日最初来源于原发性导管癌, 用了11.5个月建株。肿瘤分类为TNM IIB期, 3级。BRCA1分析表明这株细胞是BRCA1 5382C突变纯合的, 而来源于同一病人的类淋巴母细胞细胞株在这个突变位点上是杂合的。 另两个家庭成员也有这个突变; 一个同卵双生姐妹也患有乳腺癌。这株细胞有一个后天的TP53突变, 而其野生型等位基因丢失; 一个PTEN基因的后天的纯合缺失, 以及多个与乳腺癌发病机理相关的位点上发生的杂合突变。这株细胞Her2-neu和p53表达都呈阴性。;传代方法:1:2传代;4-5天传代一次。;生长特性:贴壁生长;形态特性:上皮样;多角形;相关产品有:RBMEC细胞、OE21细胞、MDAMB330细胞
HFTF Cells;背景说明:胚胎;眼;成纤维 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HeLa细胞、AX-Mel细胞、NCIH1048细胞
HLCL9B10 Cells;背景说明:淋巴母细胞瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HCC1599细胞、8402细胞、BSC40细胞
PANC0203 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SK-BR3细胞、SNU423细胞、HeLa 229细胞
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
形态特性:上皮细胞样
细胞复苏后贴壁细胞较少的问题分析:总结1:复苏过程没有问题,是否是从拿出直接放入温水,还有培养箱,二氧化碳浓度,培养基、PH值等环节。要么加GAO浓度FBS 15-20%,看看能否帮助贴壁,当然也需要考虑血清问题,还有确信拿来的细胞没问题。总结2:首先应该怀疑冻存,实际上复苏出问题的可能非常小,因为操作简单,而且死板。1、你冻存的时候是不是消化的时间过长,这是一般人所注意不到的,即使书上也不讲这个问题,太长的消化时间会让细胞复苏时失去贴壁能力,表现为先贴后死,原因是在你复苏的时候细胞已进入凋亡程序,不可逆转的死亡。2、你的冻存HAO不HAO,是什么,甘油还是DMSO,质量非常重要,否则也会死亡。3、你的冻存的量加的是不是太多,AC推荐是不超过7%,大于5%,太多也不HAO。4、你在冻存的时候是不是把DMSO混均匀,这个有一些影响,但不算太大。5、你的冻存是否按部就班,就是所温度梯度是不是把握严格,很多人容易忘却这个事情,因为这个东西流程长。6、如果你细胞污染,你是否能很快看到,我比我的导师能早一天看到污染。从这个角度讲建议去除离心这步。7、你的细胞在冻存前是否过密。还有,不赞成孵箱污染这个概念的,所有在一个孵箱里的细胞都污染一个细菌的话,这个细菌是源于孵箱的,但这不代表孵箱污染,因为孵箱无论你如何处理都有大量的细菌,问题在操作。每次污染的原因都要尽可能的找,以后就不犯同样的问题,这个很重要,不能靠猜,否则你就有可能细胞养绝Zui后换课题,这个见得太多了,别不当会事。
MPC 11 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:KLE细胞、H1105细胞、SEG-1细胞
OCI Ly3 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Tokyo Medical and Dental university 8细胞、MDAMB436细胞、CESS细胞
130-T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,3-4天换液1次。;生长特性:贴壁生长;形态特性:梭型和大的多核细胞;相关产品有:G361-mel细胞、Pt-K2细胞、SUM 159PT细胞
MMAc.SF Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:PIEC细胞、NCIH2452细胞、CDC/EU.HMEC-1细胞
BNL 1ME A.7R.1 Cells;背景说明:肝;上皮细胞;BALB/c;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HCC2218细胞、SW 1573细胞、COLO 684细胞
Tu-686 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:HEK-AD 293细胞、Tohoku Hospital Pediatrics-1细胞、ROS 17/2.8细胞
HRVEC Cells;背景说明:视网膜微血管;内皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CCK-81细胞、COLO_320DM细胞、L-6细胞
TJ905 Cells;背景说明:胶质瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CCC-HEL-1细胞、SNU-407细胞、Pa017C细胞
M-1 myeloid leukemia Cells;背景说明:髓系白血病;SL;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:NCI H69细胞、H69/P细胞、RAT2细胞
MALME 3M Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,2天换液1次。;生长特性:混合生长;形态特性:成纤维细胞;相关产品有:A204细胞、HaCaT细胞、MDCK II细胞
MRAEC Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:LNCaP C4-2B细胞、LS-123细胞、RAMSCs细胞
Eca109 Cells;背景说明:1973年建系,来自人食管中段鳞癌组织,小块法原代培养建系。BALB/c裸鼠移植成瘤。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:H283细胞、B104 [Rat neuroblastoma]细胞、H1341细胞
V79-4 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:LAN5细胞、Tissue Culture-1细胞、HPAFII细胞
SUDHL-5 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MX-1细胞、NCI-H929细胞、SKml2细胞
BE(2)M-17 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:P3X63 AG8-653细胞、GM00637B细胞、50.B1细胞
Murine Lung Epithelial-12 Cells;背景说明:肺;上皮细胞;SV40转化;FVB/N;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:OCI-LY-10细胞、JEG3细胞、HBVP细胞
UWB1.289+BRCA1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:Capan 1细胞、MDA-MB-435细胞、SUM149细胞
1742 Cells(提供STR鉴定图谱)
Abcam HeLa ITGA2 KO Cells(提供STR鉴定图谱)
AG22808 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRF444 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XG656 Cells(提供STR鉴定图谱)
C0782 Cells(提供STR鉴定图谱)
CW60309 Cells(提供STR鉴定图谱)
DD1308 Cells(提供STR鉴定图谱)
GM01889 Cells(提供STR鉴定图谱)
TE354.T Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:S.B.细胞、HCC44细胞、RS1细胞
MKN1人胃癌细胞代次低|培养基|送STR图谱
CCRF/CEM Cells;背景说明:G.E. Foley 等人建立了类淋巴母细胞细胞株CCRF-CEM。 细胞是1964年11月从一位四岁白人女性急性淋巴细胞白血病患者的外周血白血球衣中得到。此细胞系从香港收集而来。;传代方法:1:2传代。3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞样;相关产品有:M-1细胞、PL 5细胞、DHBE细胞
G 401 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:6传代,每周2-3次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:PC-9细胞、HO8910细胞、HEB细胞
PANC-04-03 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:MPC-83细胞、ADR-RES细胞、H-II-E-C3细胞
U118-MG Cells;背景说明:注意: 据报道来自不同个体的胶质母细胞瘤细胞株U-118 MG (HTB-15) 和 U-138 MG (HTB-16)有着一致的VNTR和相近的STR模式。 U-118 MG 和 U-138 MG细胞遗传学上很相似并有至少六个衍生标记染色体。 这是1966年至1969年间J. Ponten和同事从恶性神经胶质瘤中构建的细胞株中的一株(其它包括ATCC HTB-14和 ATCC HTB-16 and ATCC HTB-17)。 1987年用BM-Cycline培养6周去除了支原体污染。 ;传代方法: 消化3-5分钟。1:2传代。3天内可长满。;生长特性:贴壁生长;形态特性:混合型;相关产品有:SV-HUC细胞、brain-derived Endothelial cells.3细胞、GH 3细胞
PCI-4B Cells;背景说明:喉鳞癌;淋巴结转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:GDM-1细胞、NUGC4细胞、HUT125细胞
3H7-6 Cells(提供STR鉴定图谱)
NCI-H1975 Cells;背景说明:这株细胞于1988年七月建株。组织提供者是一位非吸烟人士。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:LS-174细胞、H-889细胞、Jurkat-E6细胞
NCI-H2023 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2次;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:G-292细胞、Stanford University-Diffuse Histiocytic Lymphoma-5细胞、HOS (TE85)细胞
NCIH1975 Cells;背景说明:这株细胞于1988年七月建株。组织提供者是一位非吸烟人士。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:SW 480细胞、Tb 1 Lu细胞、ME-1 [Human leukemia]细胞
U87 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:PANC1005细胞、ECC10细胞、RCM1细胞
DU-145 Cells;背景说明:DU 145 是从一位有3年淋巴细胞白血病史的前列腺癌患者的脑部转移灶中建立的。该细胞系未检测到激素敏感性,酸性酶阳性,单个的细胞可在软琼脂中形成集落。对此细胞和原始肿瘤的亚显微结构分析可见微绒毛、微丝、细胞桥粒、线粒体、发达的高尔基体和异质溶酶体。该细胞不表达前列腺抗原。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:HRGEC细胞、Human Pancreatic Duct Epithelial细胞、Hx-147细胞
DH 82 Cells;背景说明:肾;Golden Retrieve;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:A549/DDP细胞、MEG01细胞、IMR 32细胞
HEK-293 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Ramos 2G6.4C10细胞、OCI-Ly19细胞、NPA'87细胞
ETCC007 Cells;背景说明:原位导管癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:VP303细胞、Panc 08.13细胞、RCS细胞
GM10649 Cells(提供STR鉴定图谱)
HAP1 CD81 (-) 1 Cells(提供STR鉴定图谱)
NCIH2106 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2次。;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:GM03190细胞、RCF细胞、MN 60细胞
Primary Liver Carcinoma/Poliomyelitis Research Foundation/5 Cells;背景说明:该细胞系分泌乙肝病毒表面抗原(HBsAg)。 此细胞系原先被支原体污染,后用BM-cycline去除支原体;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:GM04671细胞、RKOE6细胞、CW2细胞
PC12(高分化) Cells;背景说明:该细胞系来自能移植的雄性大鼠肾上腺嗜铬细胞瘤。这些细胞表达神经生长因子(NGF)受体。NGF可诱导产生神经表型。这些细胞不合成。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:多角形;相关产品有:Oregon J-111细胞、HO-1-N-1细胞、PC3细胞
Hs600T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:SNK1细胞、Hs832T细胞、U20-S细胞
HTh74 Cells;背景说明:未分化甲状腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H1568细胞、KG1A细胞、KY-50细胞
OCI-Ly3 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:C8166细胞、WERI-Rb-1细胞、PLA801D细胞
C-33-A Cells;背景说明:C-33A细胞株是N. Auersperg从宫颈癌切片中建立的一系列细胞株(参见ATCC CRL-1594和ATCC CRL-1595)中的一株。 细胞一开始就表现出亚二倍体核型及上皮细胞形态。 连续传代可以观察到核型不稳定。 存在成视网膜细胞瘤蛋白(pRB),但大小不正常。 P53表达上调,且有一个273位密码子的点突变导致Arg -> Cys的替换。 人乳头瘤病毒DNA及RNA阴性。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:PVEC细胞、293c18细胞、NCI-H2107细胞
CHP100 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NIH:OVCAR-5细胞、NCI-1155细胞、PLB985细胞
HG03898 Cells(提供STR鉴定图谱)
ILT-Yan Cells(提供STR鉴定图谱)
LTEP-s Cells(提供STR鉴定图谱)
ND01443 Cells(提供STR鉴定图谱)
PCC2 Cells(提供STR鉴定图谱)
Ubigene A-549 TRIM28 KO Cells(提供STR鉴定图谱)
V79/E36 Cells(提供STR鉴定图谱)
HAP1 TMEM205 (-) 4 Cells(提供STR鉴定图谱)
CAL78 Cells;背景说明:软骨肉瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MFE-296细胞、Hs 737.T细胞、OEC19细胞
NCI-H226 Cells;背景说明:1980年分离建立。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:Doubling time: ~50 hours (ATCC).细胞、H820细胞、RA细胞
hFOB1.19 Cells;背景说明:成骨细胞;SV40转化;条件永生;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Helacyton gartleri细胞、IPLB-SF 21细胞、Ramos细胞
Sp2/0-Ag-14 Cells;背景说明:该细胞是由绵羊红细胞免疫的BALB/c小鼠脾细胞和P3X63Ag8骨髓瘤细胞融合得到的。该细胞不分泌免疫球蛋白,对20μg/ml的8-氮鸟嘌呤有抗性,对HAT比较敏感;该细胞可以作为细胞融合时的B细胞组分用于制备杂交瘤;鼠痘病毒阴性。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;圆形;相关产品有:H1404细胞、SW 1463细胞、MCAEC细胞
Mo7e Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-2196细胞、CAKI 2细胞、NCI-H510细胞
Mo7e Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-2196细胞、CAKI 2细胞、NCI-H510细胞
Panc-327 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HCEC-12细胞、SN12C细胞、SNU-C2B细胞
HOP 62 Cells;背景说明:肺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SNU886细胞、NCI-SNU-16细胞、H-1105细胞
VAESBJ Cells;背景说明:详见相关文献介绍;传代方法:1:3传代,每周2次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:ELD-1细胞、NCI-H322T细胞、MyLa2059细胞
Tokyo Medical and Dental university 8 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:CEK细胞、HB 611细胞、FLC-7细胞
MOLM-13 Cells;背景说明:急性髓系白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:NCI N87细胞、Sol8细胞、WEHI3B细胞
MOLT4 Cells;背景说明:MOLT-4与MOLT-3来源于一名19岁的男性急性淋巴细胞性白血病的复发患者,该患者前期接受过多种药物联合化疗。MOLT-4细胞系为T淋巴细胞起源,p53基因的第248位密码子有一个G→A突变,不表达p53,不表达免疫球蛋白或EB病毒;可产生高水平的末端脱氧核糖转移酶;表达CD1(49%),CD2(35%),CD3A(26%)B(33%)C(34%),CD4(55%),CD5(72%),CD6(22%),CD7(77%)。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;圆形;相关产品有:HME-1细胞、VeroE6细胞、Medical University of Graz-Chordoma 1细胞
Lewis-Lung Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCIH187细胞、CCRF细胞、HCC-1954细胞
COLO201 Cells;背景说明:该细胞源自一位70岁白人男性,CSAp (CSAp-)和CEA阴性。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮+贴壁;形态特性:淋巴细胞;相关产品有:Duke University 4475细胞、BC-PAP细胞、Karpas422细胞
SKUT1 Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:12传代,2天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:Tn5 B1-4细胞、Calf Pulmonary Artery Endothelial细胞、HepG2细胞
SCRP2306i Cells(提供STR鉴定图谱)
P3JHR1 Cells;背景说明:详见相关文献介绍;传代方法:每2-3天换液;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:CEMC7细胞、ECC-10细胞、JB6Cl30细胞
Kit-225 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:PLC8024细胞、ST486细胞、NCIH209细胞
WM-239A Cells;背景说明:黑色素瘤;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:KYSE 410细胞、BRL-3A细胞、Mel-624细胞
343 MG Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:SUD6细胞、alpha-TC1.6细胞、H-747细胞
CX-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MIA-Pa-Ca-2细胞、BV-2细胞、GM03320细胞
TGW Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:神经元细胞;相关产品有:Clone Y-1细胞、ARO细胞、RCC-JF细胞
MKN1人胃癌细胞代次低|培养基|送STR图谱
P3.NS-1/1.Ag4.1 Cells;背景说明:这是P3X63Ag8(ATCCTIB-9)的一个不分泌克隆。Kappa链合成了但不分泌。能抗0.1mM8-氮杂鸟嘌呤但不能在HAT培养基中生长。据报道它是由于缺失了3-酮类固醇还原酶活性的胆固醇营养缺陷型。检测表明肢骨发育畸形病毒(鼠痘)阴性。;传代方法:1:2传代,3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:BJAB细胞、SKUT1细胞、B16F1细胞
NCI-H1105 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2-3次;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:NCI-H1694细胞、RKO-E6细胞、Sup T-1细胞
SW839 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:RC-2细胞、Kit 225 K6细胞、SNU182细胞
NOR-10 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:ROS-17/2.8细胞、Leghorn Male Hepatoma cell line细胞、SNU398细胞
Ishikawa Cells;背景说明:详见相关文献介绍;传代方法:1:3传代,3-4天换液一次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:C166细胞、HHL5细胞、LC-1-sq细胞
RM-1 Cells;背景说明:前列腺癌;C57BL/6;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:ChaGo K-1细胞、LS-411细胞、EVSA/T细胞
H-548 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HGC27细胞、THP1细胞、FHL124细胞
QGY7701 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:FOXNY细胞、HFLS-RA细胞、MKN1细胞
BayGenomics ES cell line RRO016 Cells(提供STR鉴定图谱)
BayGenomics ES cell line YHB067 Cells(提供STR鉴定图谱)
H37-40 Cells(提供STR鉴定图谱)
PAb1624 Cells(提供STR鉴定图谱)
AG21241 Cells(提供STR鉴定图谱)
HPB-MB 17S Cells(提供STR鉴定图谱)
" "PubMed=6862145; DOI=10.20772/cancersci1959.74.2_240
Naito S., Inoue S., Kinjo M., Tanaka K.
Thromboplastic and fibrinolytic activities of cultured human gastric cancer cell lines.
Gann 74:240-247(1983)
PubMed=1778766; DOI=10.1111/j.1349-7006.1991.tb01816.x; PMCID=PMC5918361
Takeshima E., Hamaguchi M., Watanabe T., Akiyama S., Kataoka M., Ohnishi Y., Xiao H.-Y., Nagai Y., Takagi H.
Aberrant elevation of tyrosine-specific phosphorylation in human gastric cancer cells.
Jpn. J. Cancer Res. 82:1428-1435(1991)
PubMed=1933850
Yamada Y., Yoshida T., Hayashi K., Sekiya T., Yokota J., Hirohashi S., Nakatani K., Nakano H., Sugimura T., Terada M.
p53 gene mutations in gastric cancer metastases and in gastric cancer cell lines derived from metastases.
Cancer Res. 51:5800-5805(1991)
PubMed=1370612; DOI=10.1016/S0006-291X(05)80133-0
Matozaki T., Sakamoto C., Matsuda K., Suzuki T., Konda Y., Nakano O., Wada K., Uchida T., Nishisaki H., Nagao M., Kasuga M.
Missense mutations and a deletion of the p53 gene in human gastric cancer.
Biochem. Biophys. Res. Commun. 182:215-223(1992)
DOI=10.1016/B978-0-12-333530-2.50014-9
Sekiguchi M., Suzuki T.
Gastric tumor cell lines.
(In book chapter) Atlas of human tumor cell lines; Hay R.J., Park J.-G., Gazdar A.F. (eds.); pp.287-316; Academic Press; New York; USA (1994)
PubMed=9290701; DOI=10.1002/(SICI)1098-2744(199708)19:4<243::AID-MC5>3.0.CO;2-D
Jia L.-Q., Osada M., Ishioka C., Gamo M., Ikawa S., Suzuki T., Shimodaira H., Niitani T., Kudo T., Akiyama M., Kimura N., Matsuo M., Mizusawa H., Tanaka N., Koyama H., Namba M., Kanamaru R., Kuroki T.
Screening the p53 status of human cell lines using a yeast functional assay.
Mol. Carcinog. 19:243-253(1997)
PubMed=11107048; DOI=10.1046/j.1440-1827.2000.01117.x
Yokozaki H.
Molecular characteristics of eight gastric cancer cell lines established in Japan.
Pathol. Int. 50:767-777(2000)
PubMed=15723654; DOI=10.1111/j.1349-7006.2005.00016.x; PMCID=PMC11160020
Takada H., Imoto I., Tsuda H., Sonoda I., Ichikura T., Mochizuki H., Okanoue T., Inazawa J.
Screening of DNA copy-number aberrations in gastric cancer cell lines by array-based comparative genomic hybridization.
Cancer Sci. 96:100-110(2005)
PubMed=15767549; DOI=10.1158/1535-7163.MCT-04-0234
Nakatsu N., Yoshida Y., Yamazaki K., Nakamura T., Dan S., Fukui Y., Yamori T.
Chemosensitivity profile of cancer cell lines and identification of genes determining chemosensitivity by an integrated bioinformatical approach using cDNA arrays.
Mol. Cancer Ther. 4:399-412(2005)
PubMed=15900046; DOI=10.1093/jnci/dji133
Mashima T., Oh-hara T., Sato S., Mochizuki M., Sugimoto Y., Yamazaki K., Hamada J.-i., Tada M., Moriuchi T., Ishikawa Y., Kato Y., Tomoda H., Yamori T., Tsuruo T.
p53-defective tumors with a functional apoptosome-mediated pathway: a new therapeutic target.
J. Natl. Cancer Inst. 97:765-777(2005)
PubMed=20164919; DOI=10.1038/nature08768; PMCID=PMC3145113
Bignell G.R., Greenman C.D., Davies H.R., Butler A.P., Edkins S., Andrews J.M., Buck G., Chen L., Beare D., Latimer C., Widaa S., Hinton J., Fahey C., Fu B.-Y., Swamy S., Dalgliesh G.L., Teh B.T., Deloukas P., Yang F.-T., Campbell P.J., Futreal P.A., Stratton M.R.
Signatures of mutation and selection in the cancer genome.
Nature 463:893-898(2010)
PubMed=20215515; DOI=10.1158/0008-5472.CAN-09-3458; PMCID=PMC2881662
Rothenberg S.M., Mohapatra G., Rivera M.N., Winokur D., Greninger P., Nitta M., Sadow P.M., Sooriyakumar G., Brannigan B.W., Ulman M.J., Perera R.M., Wang R., Tam A., Ma X.-J., Erlander M., Sgroi D.C., Rocco J.W., Lingen M.W., Cohen E.E.W., Louis D.N., Settleman J., Haber D.A.
A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers.
Cancer Res. 70:2158-2164(2010)
PubMed=22336246; DOI=10.1016/j.bmc.2012.01.017
Kong D.-X., Yamori T.
JFCR39, a panel of 39 human cancer cell lines, and its application in the discovery and development of anticancer drugs.
Bioorg. Med. Chem. 20:1947-1951(2012)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=24807215; DOI=10.1038/ncomms4830; PMCID=PMC4024760
Liu J.-F., McCleland M.L., Stawiski E.W., Gnad F., Mayba O., Haverty P.M., Durinck S., Chen Y.-J., Klijn C., Jhunjhunwala S., Lawrence M., Liu H.-B., Wan Y.-N., Chopra V.S., Yaylaoglu M.B., Yuan W.-L., Ha C., Gilbert H.N., Reeder J., Pau G., Stinson J., Stern H.M., Manning G., Wu T.D., Neve R.M., de Sauvage F.J., Modrusan Z., Seshagiri S., Firestein R., Zhang Z.-M.
Integrated exome and transcriptome sequencing reveals ZAK isoform usage in gastric cancer.
Nat. Commun. 5:3830.1-3830.8(2014)
PubMed=25343454; DOI=10.1371/journal.pone.0111146; PMCID=PMC4208810
Choong M.-L., Tan S.-H., Tan T.-Z., Manesh S., Ngo A., Yong J.W.-Y., Yang H.H., Lee M.A.
Molecular integrative clustering of Asian gastric cell lines revealed two distinct chemosensitivity clusters.
PLoS ONE 9:E111146-E111146(2014)
PubMed=25960936; DOI=10.4161/21624011.2014.954893; PMCID=PMC4355981
Boegel S., Lower M., Bukur T., Sahin U., Castle J.C.
A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines.
OncoImmunology 3:e954893.1-e954893.12(2014)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=29435981; DOI=10.1002/ijc.31304
Kim H.J., Kang S.K., Kwon W.S., Kim T.S., Jeong I., Jeung H.-C., Kragh M., Horak I.D., Chung H.C., Rha S.Y.
Forty-nine gastric cancer cell lines with integrative genomic profiling for development of c-MET inhibitor.
Int. J. Cancer 143:151-159(2018)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=30971826; DOI=10.1038/s41586-019-1103-9
Behan F.M., Iorio F., Picco G., Goncalves E., Beaver C.M., Migliardi G., Santos R., Rao Y., Sassi F., Pinnelli M., Ansari R., Harper S., Jackson D.A., McRae R., Pooley R., Wilkinson P., van der Meer D.J., Dow D., Buser-Doepner C.A., Bertotti A., Trusolino L., Stronach E.A., Saez-Rodriguez J., Yusa K., Garnett M.J.
Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens.
Nature 568:511-516(2019)
PubMed=31068700; DOI=10.1038/s41586-019-1186-3; PMCID=PMC6697103
Ghandi M., Huang F.W., Jane-Valbuena J., Kryukov G.V., Lo C.C., McDonald E.R. 3rd, Barretina J.G., Gelfand E.T., Bielski C.M., Li H.-X., Hu K., Andreev-Drakhlin A.Y., Kim J., Hess J.M., Haas B.J., Aguet F., Weir B.A., Rothberg M.V., Paolella B.R., Lawrence M.S., Akbani R., Lu Y.-L., Tiv H.L., Gokhale P.C., de Weck A., Mansour A.A., Oh C., Shih J., Hadi K., Rosen Y., Bistline J., Venkatesan K., Reddy A., Sonkin D., Liu M., Lehar J., Korn J.M., Porter D.A., Jones M.D., Golji J., Caponigro G., Taylor J.E., Dunning C.M., Creech A.L., Warren A.C., McFarland J.M., Zamanighomi M., Kauffmann A., Stransky N., Imielinski M., Maruvka Y.E., Cherniack A.D., Tsherniak A., Vazquez F., Jaffe J.D., Lane A.A., Weinstock D.M., Johannessen C.M., Morrissey M.P., Stegmeier F., Schlegel R., Hahn W.C., Getz G., Mills G.B., Boehm J.S., Golub T.R., Garraway L.A., Sellers W.R.
Next-generation characterization of the Cancer Cell Line Encyclopedia.
Nature 569:503-508(2019)"