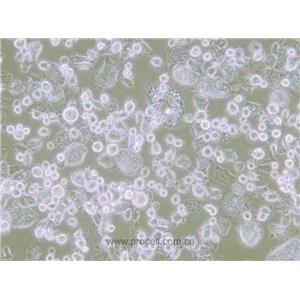
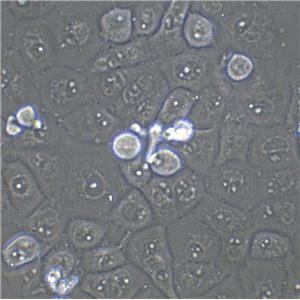
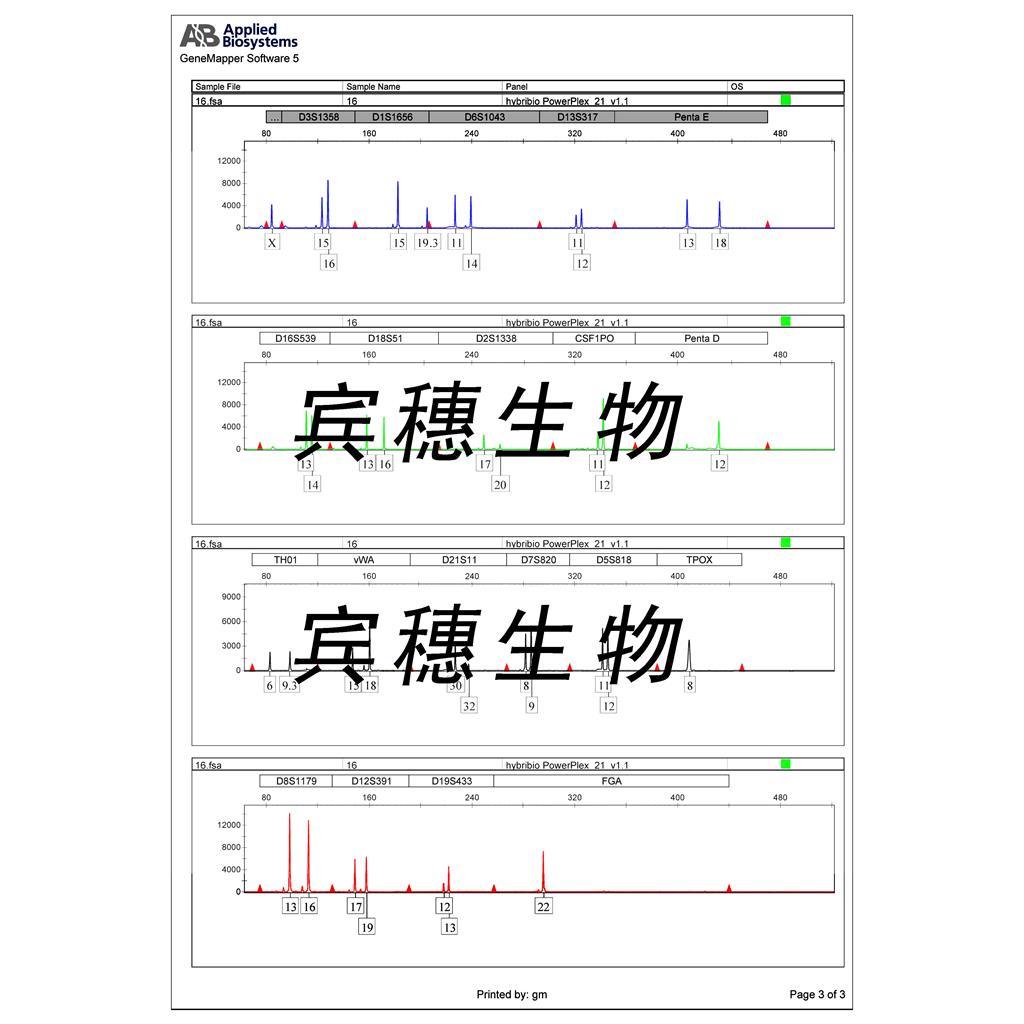
"A172人胶质母细胞瘤细胞代次低|培养基|送STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:贴壁生长
细胞系的应用:1)免疫组化研究2)RNA干扰研究3)药物作用研究4)慢病毒转染研究等其它应用。细胞系通常用于实验研究,如增殖、迁移、侵袭等。细胞系在多个领域的研究中被广泛应用,包括基础医学、临床试验、药物筛选和分子生物学研究。这些研究不仅在中国,也在日本、美国和欧洲等多个国家和地区进行。
换液周期:每周2-3次
MDA-MB436 Cells;背景说明:该细胞源于一名43岁患有乳腺腺癌女性的胸腔积液。;传代方法:1:2传代,每周换液2—3次;生长特性:贴壁生长;形态特性:多角形;相关产品有:LA-795细胞、X63Ag8.653细胞、Colon 38细胞
HT144mel Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:8传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:MDAMB435细胞、HPAF细胞、CHL1细胞
293E Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:10传代;每周2次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:INS-1E细胞、LS 174 T细胞、SHP77细胞
A172人胶质母细胞瘤细胞代次低|培养基|送STR图谱
背景信息:A172细胞在半固体培养基中可形成克隆;A172细胞在免疫抑制小鼠中不成瘤。最初分离自一名患者的胶质母细胞瘤组织,在培养中表现出典型的胶质瘤细胞形态,如多形性、核异型性、高核质比等。
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
公司细胞系主要引进ATCC、DSMZ、JCRB、KCLB、RIKEN、ECACC等细胞库,细胞系体外培养,它们会成长为单层细胞,附着或紧贴在培养瓶上,或悬浮在体外的溶液中,细胞系复苏周期短,公司细胞系状态良好,饱满,有光泽等优点。EDTA的作用:许多人不用胰酶,只用EDTA,或者用胰酶/EDTA联合作用。这里要明白,胰酶切割细胞外基质的一些负责粘连和附着的蛋白,而EDTA通过螯合Ca离子,作用于整联蛋白的活性,所以EDTA的作用更加温和。有的人在胰酶里添加一些EDTA,或者对付特别难消化的细胞,添加多一些EDTA,就是这个道理。一般不要试图延长消化时间(如果10min还消化不下来的话),而应该想其它办法。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
A172人胶质母细胞瘤细胞代次低|培养基|送STR图谱
物种来源:人源、鼠源等其它物种来源
RFL 6 Cells;背景说明:胚肺;成纤维细胞;SD大鼠;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:BT 325细胞、HEC1-A细胞、SUM52细胞
E6-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:FRhK-4细胞、293 c18细胞、143 B细胞
NCI-H676B Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:J82细胞、CPAE细胞、A-427细胞
VERO76 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:AN3CA细胞、SCC090细胞、CAKI.1细胞
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
形态特性:上皮细胞样
细胞传代培养实验:体外培养的原代细胞或细胞株要在体外持续地培养就必须传代,以便获得稳定的细胞株或得到大量的同种细胞,并维持细胞种的延续。培养的细胞形成单层汇合以后,由于密度过大生存空间不足而引起营养枯竭,将培养的细胞分散,从容器中取出,以1:2或1:3以上的比率转移到另外的容器中进行培养,即为传代培养;细胞“一代”指从细胞接种到分离再培养的一段期间,与细胞世代或倍增不同。在一代中,细胞培增3~6次。细胞传代后,一般经过三个阶段:游离期、指数增生期和停止期。常用细胞分裂指数表示细胞增殖的旺盛程度,即细胞群的分裂相数/100个细胞。一般细胞分裂指数介于0.2%~0.5%,肿瘤细胞可达3~5%;细胞接种2~3天分裂增殖旺盛,是活力ZuiHAO时期,称指数增生期(对数生长期),适宜进行各种试验。实验步骤:1.将长成的培养细胞从二氧化碳培养箱中取出,在超净工作台中倒掉瓶内的培养,加入少许消化。(以面盖住细胞为宜),静置5~10分钟。2.在倒置镜下观察被消化的细胞,如果细胞变圆,相互之间不再连接成片,这时应立即在超净台中将消化倒掉,加入3~5ml新鲜培养,吹打,制成细胞悬。3.将细胞悬吸出2ml左右,加到另一个培养瓶中并向每个瓶中分别加3ml左右培养,盖HAO瓶塞,送回二氧化碳培养箱中,继续进行培养。一般情况,传代后的细胞在2小时左右就能附着在培养瓶壁上,2~4天就可在瓶内形成单层,需要再次进行传代。
PL 45 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:RK 13细胞、HC-11细胞、Human Embryo Lung-1细胞
HIEC Cells;背景说明:肠;上皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Hs 600.T细胞、DoHH-2细胞、CCRF.CEM细胞
HO1-N-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:143TK-细胞、NCIH847细胞、YD15细胞
NCIH2030 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:DoHH-2细胞、RH-30细胞、GP2-293细胞
FL 62891 Cells;背景说明:肝;SV40转化;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HL60细胞、NCI-SNU-216细胞、KPL-1细胞
COR L279 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:LAN-1细胞、BLO 11细胞、MDA-157细胞
COS-7 Cells;背景说明:此细胞株源自CV-1细胞株,经转染起始点缺失的SV40病毒突变体得到;编码表达野生型T抗原,所以该细胞适合作为需要SV40T抗原表达的载体的转染宿主。该细胞表达T抗原,允许SV40病毒的溶解性生长,支持40℃时温度敏感性A209病毒的复制,支持起始区域缺陷的SV40突变体的复制。因含有SV40病毒的DNA序列,该细胞需要在2级生物安全柜中操作。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:成纤维细胞样;相关产品有:U-87MG细胞、HS-695T细胞、TE-9细胞
NR8383 Cells;背景说明:NR8383(正常大鼠,1983年8月3日)来源于肺灌洗时的正常大鼠肺泡巨噬细胞。细胞在gerbil肺细胞连续培养液存在下培养了大约8-9个月。随后,不再需要外源生长因子。通过有限稀释法从单个细胞克隆并亚克隆NR8383细胞,并三次用软琼脂亚克隆。细胞表现出巨噬细胞的特性,吞噬酵母多糖和铜绿,非特异性脂酶活性,Fc受体,氧化降解;分泌IL-1,TNFbeta和IL-6,可重复地响应外源生长因子。NR8383细胞响应博莱霉素,分泌TGFbeta前体。在博莱霉素刺激下,TGFbe;传代方法:1:2传代;生长特性:半贴壁生长;形态特性:巨噬细胞;相关产品有:HAPI细胞、WM 451-Lu细胞、HEK293细胞
NCIH929 Cells;背景说明:详见相关文献介绍;传代方法:保持细胞密度在5×105—1×106 cells/ml之间,每周换液2—3次;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:U-251MG细胞、HuCCT-1细胞、MARC145细胞
VK2 (E6/E7) Cells;背景说明:阴道;上皮细胞;HPV16转化;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:COLO-320细胞、GM0637细胞、CNE1-LUC细胞
HLEpiC Cells;背景说明:晶状体;上皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Tca8113细胞、AAV293细胞、DHL5细胞
X63.Ag8.653 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCIH211细胞、GC9811-P细胞、NCI-BL1339细胞
GM2219C Cells;背景说明:MOLT-4与MOLT-3来源于一名19岁的男性急性淋巴细胞性白血病的复发患者,该患者前期接受过多种药物联合化疗。MOLT-4细胞系为T淋巴细胞起源,p53基因的第248位密码子有一个G→A突变,不表达p53,不表达免疫球蛋白或EB病毒;可产生高水平的末端脱氧核糖转移酶;表达CD1(49%),CD2(35%),CD3A(26%)B(33%)C(34%),CD4(55%),CD5(72%),CD6(22%),CD7(77%)。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;圆形;相关产品有:AK细胞、HEK 293-EBNA细胞、Loucy细胞
SK-MEL24 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:星形的;相关产品有:IGROV 1细胞、EFM192B细胞、COLO-1细胞
Pa017C Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:PLA802细胞、CWR22Rv1细胞、Li-7细胞
Pt-K1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HCC0070细胞、Kasumi-6细胞、NCI-H1373细胞
H-920 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:JVM3细胞、SNU475细胞、NCIH2052细胞
Abcam A-549 TNFSF10 KO Cells(提供STR鉴定图谱)
AG03058 Cells(提供STR鉴定图谱)
BayGenomics ES cell line CSH747 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RST053 Cells(提供STR鉴定图谱)
BEL-7402/5-FU Cells(提供STR鉴定图谱)
CHO-P22 Cells(提供STR鉴定图谱)
DA02884 Cells(提供STR鉴定图谱)
FH34 Cells(提供STR鉴定图谱)
GM08870 Cells(提供STR鉴定图谱)
BEL 7405 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:NCI-H128细胞、D-341细胞、IOSE80UBC细胞
A172人胶质母细胞瘤细胞代次低|培养基|送STR图谱
NS-1 Cells;背景说明:这是P3X63Ag8(ATCCTIB-9)的一个不分泌克隆。Kappa链合成了但不分泌。能抗0.1mM8-氮杂鸟嘌呤但不能在HAT培养基中生长。据报道它是由于缺失了3-酮类固醇还原酶活性的胆固醇营养缺陷型。检测表明肢骨发育畸形病毒(鼠痘)阴性。;传代方法:1:2传代,3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:MADB 106细胞、MLOY4细胞、KYSE-140细胞
REC Cells;背景说明:详见相关文献介绍;传代方法:1:3—1:6传代,2-3天换液1次;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:JROECL21细胞、SUD6细胞、C4-2B细胞
Hs940T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:A549/ATCC细胞、OCI AML5细胞、SGC-996细胞
MFM223 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:TMD8细胞、Hepatoma 22细胞、P3J-HR-1细胞
A253 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:RPE-hTERT细胞、ME16C细胞、LED-WiDr细胞
Ba/F3 EGFR-V834L/L858R Cells(提供STR鉴定图谱)
SNB.19 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:LLC-MK2细胞、Alpha Mouse Liver 12细胞、KYSE-180细胞
293/EBNA-1 Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:10传代;每周2次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:SK_N_FI细胞、Ly3细胞、U2-OS细胞
OCI-LY-7 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HEC-251细胞、SK-ES-1细胞、Hamster Islet Transformed-Tioguanine resistant clone 15细胞
Normal Rat, August 3, 1983 Cells;背景说明:NR8383(正常大鼠,1983年8月3日)来源于肺灌洗时的正常大鼠肺泡巨噬细胞。细胞在gerbil肺细胞连续培养液存在下培养了大约8-9个月。随后,不再需要外源生长因子。通过有限稀释法从单个细胞克隆并亚克隆NR8383细胞,并三次用软琼脂亚克隆。细胞表现出巨噬细胞的特性,吞噬酵母多糖和铜绿,非特异性脂酶活性,Fc受体,氧化降解;分泌IL-1,TNFbeta和IL-6,可重复地响应外源生长因子。NR8383细胞响应博莱霉素,分泌TGFbeta前体。在博莱霉素刺激下,TGFbe;传代方法:1:2传代;生长特性:半贴壁生长;形态特性:巨噬细胞;相关产品有:HL-60 clone15细胞、Rat 1细胞、HOK细胞
SKMEL2 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:多边形的;相关产品有:Tca-83细胞、SW1353细胞、GM04679细胞
NCIH128 Cells;背景说明:小细胞肺癌;胸腔积液转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MC3T3, E1 subgroup-4 clone细胞、EBTr (NBL-4)细胞、G361mel细胞
HCC-1359 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SUM-159PT细胞、NIH:OVCAR-4细胞、Karpas-299细胞
Homo sapiens No. 578, breast cells Cells;背景说明:乳腺 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:TMK-1细胞、Ramos.2G6.4C10细胞、COLO 206F细胞
GM24591 Cells(提供STR鉴定图谱)
HAP1 NONO (-) 2 Cells(提供STR鉴定图谱)
SNU398 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:G 401细胞、SKUT-1细胞、SK-N-BE(2)-C细胞
SW900 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCI-H510细胞、HCA7细胞、BxPC-3细胞
MNNG/HOS Cells;背景说明:骨肉瘤;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H2195细胞、Hs-852-T细胞、OCI-LY-3细胞
6-T CEM Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:1.1B4细胞、TR146细胞、Walker256细胞
RKN Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:Tu177细胞、OE33细胞、ECV304细胞
Hs 746.T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SK_N_BE2C细胞、U87 MG细胞、Pt K2 (NBL-5)细胞
HIC Cells;背景说明:小肠癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:hA549细胞、GP2d细胞、SF 763细胞
Caco 2 Cells;背景说明:细胞株分离自一个原发性结肠癌。当细胞长满时,表现出典型的肠细胞分化的特征。Caco-2细胞表达维生素A酸结合蛋白I和视黄醇结合蛋白II,角蛋白阳性。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:HEM-L细胞、hSCC-25细胞、FRO细胞
Hs Cells(提供STR鉴定图谱)
KM-1 Cells(提供STR鉴定图谱)
ML-DmD16-c4 Cells(提供STR鉴定图谱)
NRK-49F Cells(提供STR鉴定图谱)
RECC-KU27 Cells(提供STR鉴定图谱)
tsAUXB1 Cells(提供STR鉴定图谱)
UKWNLi001-A Cells(提供STR鉴定图谱)
HAP1 TRAP1 (-) 1 Cells(提供STR鉴定图谱)
CEM.C1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:10RGB细胞、NCIH23细胞、MN-9D细胞
HT 1197 Cells;背景说明:详见相关文献介绍;传代方法:1:5-1:10传代,2天换液1次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:RFL 6细胞、HEK293-FT细胞、IALM细胞
NG10815 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:P30-OHK细胞、B78细胞、IOSE-80细胞
L-02 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H4IIE细胞、H-2330细胞、ECC 12细胞
NCI-H2172 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:Pt K1细胞、NPC-TW 039细胞、Detroit 562细胞
NCI-H2172 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:Pt K1细胞、NPC-TW 039细胞、Detroit 562细胞
KOPN8 Cells;背景说明:B淋巴细胞白血病;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HCC 94细胞、OE-19细胞、BS-C-1细胞
H345 Cells;背景说明:小细胞肺癌;骨髓转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NPC-TW039细胞、UMR106细胞、P3-X63-Ag8细胞
hTERT-HME-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:293-EBNA细胞、HGF-1细胞、KOPN-8细胞
ChaGo-K1 Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:8传代;每周换液2次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:U-118 MG细胞、MDA-330细胞、alpha TC1.6细胞
NCI-H2342 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:6传代 ;生长特性:贴壁生长;形态特性:上皮样;相关产品有:174xCEM.T2细胞、NCIH889细胞、hEEC细胞
NCI-H295R Cells;背景说明:肾上腺皮质癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:OCI-LY-8细胞、MIA-PaCa-2细胞、NCI-H1954细胞
HCC4006 Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:6传代,每周2-3次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:KAT-5细胞、HCC-94细胞、H-1184细胞
A375.S2 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:DMS-153细胞、NH6细胞、NOZAWA细胞
KY-50 Cells;背景说明:食管鳞癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CL MC/9细胞、NCI-SNU-407细胞、Hs 606细胞
STBCi069-B Cells(提供STR鉴定图谱)
Roswell Park Memorial Institute 1846 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:PLC PRF 5细胞、HuT-102细胞、GM02219细胞
COV-362 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:BAEC细胞、MKN45细胞、PLB 985细胞
U-343-MG Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:OUMS-27细胞、CMT 93细胞、H1568细胞
H-2195 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-226细胞、Hs683细胞、D324 Med细胞
Renal Proximal Tubule Epithelial Cells/TERT-immortalized 1 Cells;背景说明:肾;近端小管上皮;HGNC-TERT转化;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H-69细胞、WI38细胞、H-292细胞
Institute for Medical Research-90 Cells;背景说明:W.W. Nichols及其同事从一位16周女婴的肺中取材,建立了人二倍体成纤维细胞株IMR-90。分裂潜能,病毒感受性和其它性质都得到了充分研究,因而这株细胞可以作为WI-38或其它标准人肺细胞株的替代株。有报道称这株细胞在表现出衰老前可倍增58次。;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:CACO2细胞、NCIH2009细胞、NCI-H322T细胞
A172人胶质母细胞瘤细胞代次低|培养基|送STR图谱
HCC-44 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NU-GC-2细胞、BLO11细胞、TH1细胞
NW38 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H1648细胞、MDA MB 361细胞、NTERA2-D1细胞
KU 812F Cells;背景说明:慢性粒细胞白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:RPMI-8226S细胞、MRC-9细胞、HCC1171细胞
TE-14 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:A-20细胞、SF 767细胞、SCLC-21H细胞
VMM-5A Cells;背景说明:黑色素瘤;神经节转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CC-LP-I细胞、CWR-22rv1细胞、HOMEC细胞
TGBC11TKB Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:NCIH2085细胞、KU-19-19细胞、HSC-6细胞
NTERA2-D1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SN12PM6细胞、SCC-25细胞、SuperTube细胞
KYSE-30 Cells;背景说明:来源于一位64岁,患有高分化的中段食管鳞癌的男性患者。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:769-P细胞、CCD-841-CoN细胞、Sc-1细胞
BayGenomics ES cell line CSH743 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RST050 Cells(提供STR鉴定图谱)
BRIC 110 Cells(提供STR鉴定图谱)
L1 Cells(提供STR鉴定图谱)
PMab-48 Cells(提供STR鉴定图谱)
R74 Cells(提供STR鉴定图谱)
" "PubMed=212188
Todaro G.J., De Larco J.E.
Growth factors produced by sarcoma virus-transformed cells.
Cancer Res. 38:4147-4154(1978)
PubMed=450131; DOI=10.1038/279797a0
Day R.S. 3rd, Ziolkowski C.H.J.
Human brain tumour cell strains with deficient host-cell reactivation of N-methyl-N'-nitro-N-nitrosoguanidine-damaged adenovirus 5.
Nature 279:797-799(1979)
PubMed=6256643; DOI=10.1038/288724a0
Day R.S. 3rd, Ziolkowski C.H.J., Scudiero D.A., Meyer S.A., Lubiniecki A.S., Girardi A.J., Galloway S.M., Bynum G.D.
Defective repair of alkylated DNA by human tumour and SV40-transformed human cell strains.
Nature 288:724-727(1980)
PubMed=6260907; DOI=10.1097/00005072-198105000-00001
Bigner D.D., Bigner S.H., Ponten J., Westermark B., Mahaley M.S. Jr., Ruoslahti E., Herschman H.R., Eng L.F., Wikstrand C.J.
Heterogeneity of genotypic and phenotypic characteristics of fifteen permanent cell lines derived from human gliomas.
J. Neuropathol. Exp. Neurol. 40:201-229(1981)
PubMed=6954533; DOI=10.1073/pnas.79.7.2194; PMCID=PMC346157
Westin E.H., Gallo R.C., Arya S.K., Eva A., Souza L.M., Baluda M.A., Aaronson S.A., Wong-Staal F.
Differential expression of the amv gene in human hematopoietic cells.
Proc. Natl. Acad. Sci. U.S.A. 79:2194-2198(1982)
PubMed=6220172
Dracopoli N.C., Fogh J.
Polymorphic enzyme analysis of cultured human tumor cell lines.
J. Natl. Cancer Inst. 70:469-476(1983)
PubMed=6652614; DOI=10.1016/0165-4608(83)90091-2
Bigner S.H., Mark J., Bigner D.D.
Chromosomal composition of four permanent cultured cell lines derived from human gliomas.
Cancer Genet. Cytogenet. 10:335-349(1983)
PubMed=6825208; DOI=10.1093/carcin/4.2.199
Yarosh D.B., Foote R.S., Mitra S., Day R.S. 3rd
Repair of O6-methylguanine in DNA by demethylation is lacking in Mer- human tumor cell strains.
Carcinogenesis 4:199-205(1983)
PubMed=3518877; DOI=10.3109/07357908609038260
Fogh J.
Human tumor lines for cancer research.
Cancer Invest. 4:157-184(1986)
PubMed=3759084; DOI=10.1007/BF00278796
Henn W., Blin N., Zang K.-D.
Polysomy of chromosome 7 is correlated with overexpression of the erbB oncogene in human glioblastoma cell lines.
Hum. Genet. 74:104-106(1986)
PubMed=3675803
Bigner S.H., Bjerkvig R., Laerum O.D., Muhlbaier L.H., Bigner D.D.
DNA content and chromosomes in permanent cultured cell lines derived from malignant human gliomas.
Anal. Quant. Cytol. Histol. 9:435-444(1987)
PubMed=1385192; DOI=10.1016/0531-5565(92)90007-m
Fleming T.P., Matsui T., Aaronson S.A.
Platelet-derived growth factor (PDGF) receptor activation in cell transformation and human malignancy.
Exp. Gerontol. 27:523-532(1992)
DOI=10.1016/B978-0-12-333530-2.50005-8
Nister M., Westermark B.
Human glioma cell lines.
(In book chapter) Atlas of human tumor cell lines; Hay R.J., Park J.-G., Gazdar A.F. (eds.); pp.17-42; Academic Press; New York; USA (1994)
PubMed=7523863; DOI=10.1128/mcb.14.11.7604-7610.1994; PMCID=PMC359296
Pomykala H.M., Bohlander S.K., Broeker P.L., Olopade O.I., Diaz M.O.
Breakpoint junctions of chromosome 9p deletions in two human glioma cell lines.
Mol. Cell. Biol. 14:7604-7610(1994)
PubMed=9090379; DOI=10.1038/ng0497-356
Steck P.A., Pershouse M.A., Jasser S.A., Yung W.-K.A., Lin H., Ligon A.H., Langford L.A., Baumgard M.L., Hattier T., Davis T., Frye C., Hu R., Swedlund B., Teng D.H.-F., Tavtigian S.V.
Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancers.
Nat. Genet. 15:356-362(1997)
PubMed=9220028; DOI=10.1016/S0303-7207(97)00080-4
Sharif T.R., Luo W., Sharif M.
Functional expression of bombesin receptor in most adult and pediatric human glioblastoma cell lines; role in mitogenesis and in stimulating the mitogen-activated protein kinase pathway.
Mol. Cell. Endocrinol. 130:119-130(1997)
PubMed=9290701; DOI=10.1002/(SICI)1098-2744(199708)19:4<243::AID-MC5>3.0.CO;2-D
Jia L.-Q., Osada M., Ishioka C., Gamo M., Ikawa S., Suzuki T., Shimodaira H., Niitani T., Kudo T., Akiyama M., Kimura N., Matsuo M., Mizusawa H., Tanaka N., Koyama H., Namba M., Kanamaru R., Kuroki T.
Screening the p53 status of human cell lines using a yeast functional assay.
Mol. Carcinog. 19:243-253(1997)
PubMed=9842975; DOI=10.1002/(SICI)1097-0215(19981218)79:6<640::AID-IJC15>3.0.CO;2-z
Weller M., Rieger J., Grimmel C., Van Meir E.G., De Tribolet N., Krajewski S., Reed J.C., von Deimling A., Dichgans J.
Predicting chemoresistance in human malignant glioma cells: the role of molecular genetic analyses.
Int. J. Cancer 79:640-644(1998)
DOI=10.1007/0-306-46861-1_11
Ali-Osman F.
Brain tumors.
(In book chapter) Human cell culture. Vol. 2. Cancer cell lines part 2; Masters J.R.W., Palsson B.O. (eds.); pp.167-184; Kluwer Academic Publishers; New York; USA (1999)
PubMed=10402232; DOI=10.3892/ijo.15.2.237
Sharif T.R., Sharif M.
Overexpression of protein kinase C epsilon in astroglial brain tumor derived cell lines and primary tumor samples.
Int. J. Oncol. 15:237-243(1999)
PubMed=10416987; DOI=10.1111/j.1750-3639.1999.tb00536.x; PMCID=PMC8098486
Ishii N., Maier D., Merlo A., Tada M., Sawamura Y., Diserens A.-C., Van Meir E.G.
Frequent co-alterations of TP53, p16/CDKN2A, p14ARF, PTEN tumor suppressor genes in human glioma cell lines.
Brain Pathol. 9:469-479(1999)
PubMed=10698499; DOI=10.1038/sj.onc.1203409
Ciesielski M.J., Fenstermaker R.A.
Oncogenic epidermal growth factor receptor mutants with tandem duplication: gene structure and effects on receptor function.
Oncogene 19:810-820(2000)
PubMed=11351043; DOI=10.1038/labinvest.3780280
Hui A.B.-Y., Lo K.-W., Yin X.-L., Poon W.-S., Ng H.-K.
Detection of multiple gene amplifications in glioblastoma multiforme using array-based comparative genomic hybridization.
Lab. Invest. 81:717-723(2001)
PubMed=14614447; DOI=10.1038/sj.onc.1207198
Wischhusen J., Naumann U., Ohgaki H., Rastinejad F., Weller M.
CP-31398, a novel p53-stabilizing agent, induces p53-dependent and p53-independent glioma cell death.
Oncogene 22:8233-8245(2003)
PubMed=14655754; DOI=10.1111/j.1750-3639.2003.tb00479.x; PMCID=PMC8095903
Bahr O., Rieger J., Duffner F., Meyermann R., Weller M., Wick W.
P-glycoprotein and multidrug resistance-associated protein mediate specific patterns of multidrug resistance in malignant glioma cell lines, but not in primary glioma cells.
Brain Pathol. 13:482-494(2003)
PubMed=15900046; DOI=10.1093/jnci/dji133
Mashima T., Oh-hara T., Sato S., Mochizuki M., Sugimoto Y., Yamazaki K., Hamada J.-i., Tada M., Moriuchi T., Ishikawa Y., Kato Y., Tomoda H., Yamori T., Tsuruo T.
p53-defective tumors with a functional apoptosome-mediated pathway: a new therapeutic target.
J. Natl. Cancer Inst. 97:765-777(2005)
PubMed=16232199; DOI=10.1111/j.1349-7006.2005.00099.x; PMCID=PMC11159392
Saigusa K., Hashimoto N., Tsuda H., Yokoi S., Maruno M., Yoshimine T., Aoyagi M., Ohno K., Imoto I., Inazawa J.
Overexpressed Skp2 within 5p amplification detected by array-based comparative genomic hybridization is associated with poor prognosis of glioblastomas.
Cancer Sci. 96:676-683(2005)
PubMed=16697959; DOI=10.1016/j.ccr.2006.03.030
Lee J., Kotliarova S., Kotliarov Y., Li A.-G., Su Q., Donin N.M., Pastorino S., Purow B.W., Christopher N., Zhang W., Park J.K., Fine H.A.
Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines.
Cancer Cell 9:391-403(2006)
PubMed=17254797; DOI=10.1016/j.biologicals.2006.10.001
Azari S., Ahmadi N., Jeddi-Tehrani M., Shokri F.
Profiling and authentication of human cell lines using short tandem repeat (STR) loci: report from the National Cell Bank of Iran.
Biologicals 35:195-202(2007)
PubMed=17595512; DOI=10.1159/000104150
Rieger J., Frank B., Weller M., Wick W.
Mechanisms of resistance of human glioma cells to Apo2 ligand/TNF-related apoptosis-inducing ligand.
Cell. Physiol. Biochem. 20:23-34(2007)
PubMed=19365568; DOI=10.1371/journal.pone.0005209; PMCID=PMC2666263
Bax D.A., Little S.E., Gaspar N., Perryman L., Marshall L., Viana-Pereira M., Jones T.A., Williams R.D., Grigoriadis A., Vassal G., Workman P., Sheer D., Reis R.M., Pearson A.D.J., Hargrave D., Jones C.
Molecular and phenotypic characterisation of paediatric glioma cell lines as models for preclinical drug development.
PLoS ONE 4:E5209-E5209(2009)
PubMed=19435942; DOI=10.1215/15228517-2009-025; PMCID=PMC2743214
Ichimura K., Pearson D.M., Kocialkowski S., Backlund L.M., Chan R., Jones D.T.W., Collins V.P.
IDH1 mutations are present in the majority of common adult gliomas but rare in primary glioblastomas.
Neuro-oncol. 11:341-347(2009)
PubMed=20164919; DOI=10.1038/nature08768; PMCID=PMC3145113
Bignell G.R., Greenman C.D., Davies H.R., Butler A.P., Edkins S., Andrews J.M., Buck G., Chen L., Beare D., Latimer C., Widaa S., Hinton J., Fahey C., Fu B.-Y., Swamy S., Dalgliesh G.L., Teh B.T., Deloukas P., Yang F.-T., Campbell P.J., Futreal P.A., Stratton M.R.
Signatures of mutation and selection in the cancer genome.
Nature 463:893-898(2010)
PubMed=20215515; DOI=10.1158/0008-5472.CAN-09-3458; PMCID=PMC2881662
Rothenberg S.M., Mohapatra G., Rivera M.N., Winokur D., Greninger P., Nitta M., Sadow P.M., Sooriyakumar G., Brannigan B.W., Ulman M.J., Perera R.M., Wang R., Tam A., Ma X.-J., Erlander M., Sgroi D.C., Rocco J.W., Lingen M.W., Cohen E.E.W., Louis D.N., Settleman J., Haber D.A.
A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers.
Cancer Res. 70:2158-2164(2010)
PubMed=21406405; DOI=10.1158/0008-5472.CAN-10-3112
Grzmil M., Morin P. Jr., Lino M.M., Merlo A., Frank S., Wang Y.-H., Moncayo G., Hemmings B.A.
MAP kinase-interacting kinase 1 regulates SMAD2-dependent TGF-beta signaling pathway in human glioblastoma.
Cancer Res. 71:2392-2402(2011)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=22570425; DOI=10.1093/neuonc/nos072; PMCID=PMC3367844
Bady P., Diserens A.-C., Castella V., Kalt S., Heinimann K., Hamou M.-F., Delorenzi M., Hegi M.E.
DNA fingerprinting of glioma cell lines and considerations on similarity measurements.
Neuro-oncol. 14:701-711(2012)
PubMed=23637631; DOI=10.1371/journal.pgen.1003464; PMCID=PMC3636093
Giacomini C.P., Sun S., Varma S., Shain A.H., Giacomini M.M., Balagtas J.M.S., Sweeney R.T., Lai E., Del Vecchio C.A., Forster A.D., Clarke N., Montgomery K.D., Zhu S., Wong A.J., van de Rijn M., West R.B., Pollack J.R.
Breakpoint analysis of transcriptional and genomic profiles uncovers novel gene fusions spanning multiple human cancer types.
PLoS Genet. 9:E1003464-E1003464(2013)
PubMed=25984343; DOI=10.1038/sdata.2014.35; PMCID=PMC4432652
Cowley G.S., Weir B.A., Vazquez F., Tamayo P., Scott J.A., Rusin S., East-Seletsky A., Ali L.D., Gerath W.F.J., Pantel S.E., Lizotte P.H., Jiang G.-Z., Hsiao J., Tsherniak A., Dwinell E., Aoyama S., Okamoto M., Harrington W., Gelfand E.T., Green T.M., Tomko M.J., Gopal S., Wong T.C., Li H.-B., Howell S., Stransky N., Liefeld T., Jang D., Bistline J., Meyers B.H., Armstrong S.A., Anderson K.C., Stegmaier K., Reich M., Pellman D., Boehm J.S., Mesirov J.P., Golub T.R., Root D.E., Hahn W.C.
Parallel genome-scale loss of function screens in 216 cancer cell lines for the identification of context-specific genetic dependencies.
Sci. Data 1:140035-140035(2014)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=30188626; DOI=10.1134/S1990519X16050072
Kiseleva L.N., Kartashev A.V., Vartanyan N.L., Pinevich A.A., Samoylovich M.P.
Characteristics of A172 and T98G cell lines.
Tsitologiia 58:349-355(2016)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=30971826; DOI=10.1038/s41586-019-1103-9
Behan F.M., Iorio F., Picco G., Goncalves E., Beaver C.M., Migliardi G., Santos R., Rao Y., Sassi F., Pinnelli M., Ansari R., Harper S., Jackson D.A., McRae R., Pooley R., Wilkinson P., van der Meer D.J., Dow D., Buser-Doepner C.A., Bertotti A., Trusolino L., Stronach E.A., Saez-Rodriguez J., Yusa K., Garnett M.J.
Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens.
Nature 568:511-516(2019)
PubMed=31068700; DOI=10.1038/s41586-019-1186-3; PMCID=PMC6697103
Ghandi M., Huang F.W., Jane-Valbuena J., Kryukov G.V., Lo C.C., McDonald E.R. 3rd, Barretina J.G., Gelfand E.T., Bielski C.M., Li H.-X., Hu K., Andreev-Drakhlin A.Y., Kim J., Hess J.M., Haas B.J., Aguet F., Weir B.A., Rothberg M.V., Paolella B.R., Lawrence M.S., Akbani R., Lu Y.-L., Tiv H.L., Gokhale P.C., de Weck A., Mansour A.A., Oh C., Shih J., Hadi K., Rosen Y., Bistline J., Venkatesan K., Reddy A., Sonkin D., Liu M., Lehar J., Korn J.M., Porter D.A., Jones M.D., Golji J., Caponigro G., Taylor J.E., Dunning C.M., Creech A.L., Warren A.C., McFarland J.M., Zamanighomi M., Kauffmann A., Stransky N., Imielinski M., Maruvka Y.E., Cherniack A.D., Tsherniak A., Vazquez F., Jaffe J.D., Lane A.A., Weinstock D.M., Johannessen C.M., Morrissey M.P., Stegmeier F., Schlegel R., Hahn W.C., Getz G., Mills G.B., Boehm J.S., Golub T.R., Garraway L.A., Sellers W.R.
Next-generation characterization of the Cancer Cell Line Encyclopedia.
Nature 569:503-508(2019)"