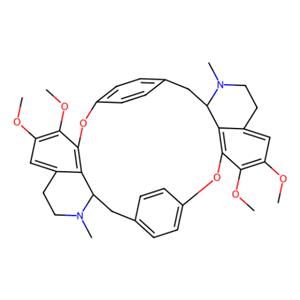
轮环藤碱 的化学性质
| CAS 编号 | 518-94-5 | SDF 系列 | 下载 SDF |
| PubChem 编号 | 121313 | 外观 | 白色结晶粉末 |
| 公式 | C38H42N2O6 | M.Wt | 622.75 |
| 化合物类型 | 生物 碱 | 存储 | 在 -20°C 下干燥 |
| 溶解度 | 溶于氯仿、二氯甲烷、乙酸乙酯、DMSO、丙酮等。 |
| 一般提示 | 为了获得更高的溶解度,请在 37 °C 下加热试管,并在超声波浴中摇晃一会儿。储备液可在 -20°C 以下储存数月。
我们建议您在同一天准备并使用该解决方案。但是,如果测试计划需要,可以提前制备储备液,并且储备液必须密封并储存在 -20°C 以下。一般来说,储备溶液可以保存几个月。
使用前,我们建议您将样品瓶在室温下放置至少一个小时,然后再打开。 |
| 关于打包 | 1. 产品包装在运输过程中可能会颠倒,导致高纯度化合物粘附在小瓶的颈部或瓶盖上。从包装中取出 vail 并轻轻摇晃,直到化合物落到样品瓶底部。
2. 对于液体产品,请以 500xg 离心,以将液体收集到样品瓶底部。
3. 实验过程中尽量避免丢失或污染。 |
| 运输条件 | 根据客户要求包装(5mg、10mg、20mg 等) |
轮环藤碱的生物活性
| 描述 | 周期嘌呤和根皮生物碱提取物的生物筛选揭示了有效的抗菌、抗真菌、抗疟原虫和细胞毒活性。Cycleanine 与其异构体 – 从 T. subcordata 中分离的 tetrandrine 一样,可能是一种潜在的新型抗卵巢癌药物,通过细胞凋亡途径起作用。它还显示出对恶性疟原虫 3D7 的抗疟原虫活性,IC50 值为 0.08 μM。Cycleanine 显着抑制 Na(+),K(+)-ATP 酶活性,IC(50) 值为 6.2 x 10(-4)M。它略微抑制 Mg(2+)-ATP 酶、H(+)-ATP 酶和 Ca(2+)-ATP 酶,它可能以 Na.E(1)-P 形式与酶相互作用,并阻止从 Na.E(1)-P 到 E(2)-P 的反应步骤。 |
| 体外 | 细胞毒性作用和周期腺素和四丁碱诱导细胞凋亡。卵巢癌仍然是所有妇科恶性肿瘤的主要死亡原因之一[1]。天然产物仍然是临床批准的抗癌药物的重要来源 [2, 3]。Triclisia subcordata Oliv (Menispermeaceae) 是一种药用植物,在西非传统上用于治疗包括癌症在内的各种疾病 [4]。本研究旨在评估 T. subcordata 中粗提取物和分离成分的体外抗卵巢癌活性。
方法和结果:
使用 Sulforhodamine B 测定方法在 Ovcar-8 、 Ovcar-4 、 A2780 和 Igrov-1 卵巢癌细胞系上筛选 T. subcordata 的乙醇提取物及其组分 (粗生物碱) 的体外抗卵巢癌活性以测量细胞生长。使用硅胶柱色谱和 HPLC 的生物测定引导分级分离用于分离生物活性化合物,其身份和结构通过 NMR 和 LC-MS 技术鉴定。Caspase 和 PARP 切割测定用于检测凋亡活性。通过流式细胞术分析分离的纯化合物对细胞周期和细胞凋亡的影响。粗生物碱在 A2780 和 Ovcar-8 细胞系的细胞生长测定中显示出最强的活性 (IC50 < 2.4 μg/mL)。使用 HPLC 分离双苄基异喹啉生物碱-轮环藤碱,并通过 MS 和 NMR 分析进行鉴定。轮环藤碱和 tetrandrine 在 A2780 、 Ovcar-8 、 Ovcar-4 和 Igrov-1 卵巢癌细胞系上的 IC50 值范围为 7 至 14 μM。轮环藤碱对人正常卵巢表面上皮细胞的 IC50 为 35 ± 1μM,提示对癌细胞具有适度选择性。轮环藤碱和 tetrandrine 均引起细胞凋亡,如半胱天冬酶 3/7 的激活和聚 (ADP) 核糖聚合酶 (PARP) 的裂解形成 PARP-I 所示。与对照相比,轮环藤碱 和 tetrandrine 暴露于细胞 48 h 后 Ovcar-8 细胞在 subG1 期的百分比增加。
结论:
总之,轮环藤碱与其异构体 – 从 T. subcordata 中分离的 tetrandrine 一样,可能是一种潜在的新型抗卵巢癌药物,通过细胞凋亡途径起作用。 来自大叶放线菌茎皮的异喹啉生物碱的抗疟疾活性。方法和结果:
本研究从大叶放线菌树皮中分离的 7 种异喹啉生物碱在体外显示出对恶性疟原虫 3D7 的体外抗疟原虫活性,对 轮环藤碱、10-demethyl xylopinine、reticuline、laurotetanine、biculine、α-hydrastine 和 anolobine 的 IC50 值分别为 0.08 μM 、 0.05 μM 、 1.18 μM、 3.11 μM、 0.65 μM、 0.26 μM 和 1.38 μM,与参考标准相当, 氯喹。
结论:
发现 10-Demethylxylopinine 是这些化合物中最活跃的。 Albertisia villos 的抗菌、抗真菌、抗疟原虫和细胞毒活性Albertisia villosa (Menispermaceae) 是一种亚热带药用植物,广泛用于非洲传统药物中,用于治疗各种疾病。
方法和结果:
三种已知的双苄基异喹啉生物碱;已鉴定出 轮环藤碱、cocsoline 和 N-desmethyl轮环藤碱。轮环藤碱是所有已鉴定的双苄基异喹啉生物碱中最丰富的 (85%),占生药的所有活性。轮环藤碱和根皮生物碱提取物的生物筛选揭示了有效的抗菌、抗真菌、抗疟原虫和细胞毒活性。
结论:
这些结果可能部分解释和支持在刚果传统医学中使用 Albertisia villosa 根皮治疗疟疾和其他传染病。 |
轮环藤碱的实验方案
| 激酶检测 | 双苄基异喹啉生物碱对活化巨噬细胞中一氧化氮产生的抑制作用。Stephania cephararantha Hayata 和双苄基异喹啉生物碱 轮环藤碱(一种主要成分)的提取物对 Na+,K+-ATP 酶的抑制。研究了 Stephania cephararantha HAYATA 提取物及其组成双苄基异喹啉生物碱,如轮环藤碱、头孢嘌呤、异四胺、小檗、高阿莫林和头孢啉对 Na(+),K(+)-ATP 酶活性的影响。
方法和结果:
S. cephararantha HAYATA 提取物抑制 Na (+),K(+) -ATP 酶活性,表观 IC (50) 值为 540 μg/mL。轮环藤碱显着抑制 Na(+),K(+)-ATP 酶活性,IC(50) 值为 6.2 x 10(-4)M。它略微抑制 Mg(2+)-ATP 酶、H(+)-ATP 酶和 Ca(2+)-ATP 酶。未观察到对碱性和酸性磷酸酶活性的影响。异四氮碱、高羟莫林、头孢嘌和小檗碱的抑制作用较弱,头孢素无效果。头孢喹嘌的 5 种合成类似物略微抑制了该活性。详细研究了 轮环藤碱对 Na(+),K(+)-ATP 酶活性的抑制机制,并在整体反应中获得了以下结果:(1) 抑制模式相对于 ATP 是非竞争性的;(2) 抑制程度随 K(+) 浓度的降低而降低;(3) 不受 Na(+) 浓度的影响;(4) 抑制机制与 Ouabain 不同。K(+) 依赖性对硝基苯基磷酸酶的活性,即 Na(+),K(+)-ATP 酶的部分反应,在含有 15 mM K(+) 的反应混合物中似乎没有被轮环藤碱抑制(最佳条件)。然而,轮环藤碱增加了 K(+) 依赖性对硝基苯基磷酸酶中 K(+) 的 K(0.5) 值并降低了 Na(+) 和 ATP 的 K(i) 值。
结论:
轮环藤碱可能与 Na.E(1)-P 形式的酶相互作用,并阻止从 Na.E(1)-P 到 E(2)-P 的反应步骤。 双苄基异喹啉 (BBI) 生物碱是半月形菌科和毛茛科植物的抗炎成分,在日本和中国已被用作民间疗法。
方法和结果:
测试了 5 种 BBI 生物碱 (头孢嘌呤、软骨库林、轮环藤碱、异四君碱和四丁碱) 对脂多糖刺激的腹膜巨噬细胞产生一氧化氮 (NO) 产生的抑制作用,这些巨噬细胞用巯基乙酸盐或卡介苗诱导小鼠。
结论:
所有这些 BBI 生物碱均显著抑制 5 μg/mL 的 NO 产生。头孢嘌呤、异四胺和赛克林的抑制作用略高于四胺和软骨库林。抑制持续至少 48 小时。由于 NO 是炎症的关键介质之一,这些结果可能解释了 BBI 化合物抗炎机制的某些方面。 |
| 细胞研究 | (氨基烷基)环烯胺类似物的合成:卵巢癌细胞中的细胞毒性、细胞摄取和细胞凋亡诱导。我们之前的研究表明,轮环藤碱是一种大环双苄基异喹啉 (BBIQ) 生物碱,通过细胞凋亡诱导显示出有效的抗卵巢癌活性。
方法和结果:
在这里,我们通过简单高效的两步反应合成了两种新型(氨基烷基)轮环藤碱类似物 (2 和 3),该反应从从 Triclisia subcordata Oliv 中分离的轮环藤碱开始。这些类似物在三种人卵巢癌细胞系中显示出比未修饰的 轮环藤碱 更高的效力。2 和 3 均通过激活 caspase 3/7、裂解 PARP、增加 subG1 细胞周期期和凋亡细胞的百分比来诱导卵巢癌细胞凋亡。进一步的共聚焦荧光显微镜分析证实了卵巢癌细胞中生物碱的细胞摄取,方法是使用独特的(炔基)轮环藤碱(3) 通过点击化学反应。
结论:
我们的结果表明,轮环藤碱 可能是未来攻击卵巢癌的热门化合物。 |
| 结构鉴定 | 方法和结果:
轮环藤碱 是一种双苄基异喹啉生物碱,已从 Synclisia scabrida 的根中分离出来。300 MHz 处的 1H NMR 波谱显示,在氯仿溶液中,轮环藤碱具有环 B 部分屏蔽环 C′ 的构象,而环 C 同样受到环 B′ 的影响。 |
制备 轮环藤碱储备液
| 1 毫克 | 5 毫克 | 10 毫克 | 20 毫克 | 25 毫克 |
| 1 毫米 | 1.6058 毫升 | 8.0289 毫升 | 16.0578 毫升 | 32.1156 毫升 | 40.1445 毫升 |
| 5 毫米 | 0.3212 毫升 | 1.6058 毫升 | 3.2116 毫升 | 6.4231 毫升 | 8.0289 毫升 |
| 10 毫米 | 0.1606 毫升 | 0.8029 毫升 | 1.6058 毫升 | 3.2116 毫升 | 4.0145 毫升 |
| 50 毫米 | 0.0321 毫升 | 0.1606 毫升 | 0.3212 毫升 | 0.6423 毫升 | 0.8029 毫升 |
| 100 毫米 | 0.0161 毫升 | 0.0803 毫升 | 0.1606 毫升 | 0.3212 毫升 | 0.4014 毫升 |
| *注意:如果 你正在实验过程中,有必要制作 样品的稀释比例。上述稀释数据 仅供参考。通常,它可以变得更好 在较低浓度内的溶解度。 |
CAS号518-94-5对应的化学物质是轮环藤碱。以下是对轮环藤碱的详细介绍:
一、基本信息
二、物理性质
密度:1.172±0.06 g/cm3(预测值)或1.2±0.1 g/cm3
沸点:691.6±55.0 °C(预测值)或691.6°C at 760 mmHg
熔点:272~273 °C
闪点:169.8±28.7 °C
折射率:1.585或1.586
形态:固体,白色结晶粉末
溶解度:可溶于丙酮、二氯甲烷、DMSO、乙酸乙酯等有机溶剂
三、来源与提取
轮环藤碱主要来源于白药子、地不容、光叶地不容、南轮环藤、四川轮环藤、瓦氏独活、锡生藤等植物。可以通过乙醇浸提、酸水萃取、氯仿萃取等方法从植物中提取得到。
四、药理作用
抗肿瘤作用:轮环藤碱具有抗肿瘤活性,特别是对卵巢癌等肿瘤细胞具有显著的细胞毒性作用。
抗感染作用:轮环藤碱能够抑制过度活化的巨噬细胞内iNOS表达,从而抑制LPS诱导的巨噬细胞NO释放,同时还具有抑制炎症因子释放的作用。
血管选择性钙拮抗剂:轮环藤碱是一种有效的血管选择性钙拮抗剂,可用于相关研究或药物制备中。
五、其他用途
轮环藤碱还可用于含量测定、鉴别以及药理实验等科研领域。
六、储存条件
轮环藤碱应在4°C或-20°C下,干燥、避光、密封储存,以防止其变质或失效。
七、安全信息
在使用轮环藤碱时,应严格遵守相关的安全操作规程和实验室规范。对于轮环藤碱的毒性、致敏性等安全信息,应在使用前进行充分的了解和评估。
综上所述,轮环藤碱是一种具有多种药理作用和潜在应用价值的化学物质,在抗肿瘤、抗感染以及科研领域等方面具有广泛的应用前景。