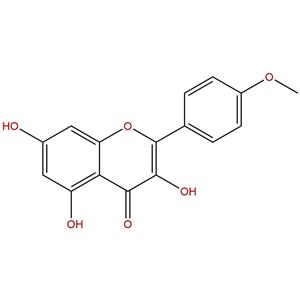
山奈素,491-54-3,自制中药标准品对照品;科研实验;HPLC≥98%
Kaempferide
491-54-3
491-54-3
¥120
20mg
起订
湖北 更新日期:2026-02-09
产品详情:
- 中文名称:
- 山奈素
- 英文名称:
- Kaempferide
- CAS号:
- 491-54-3
- 品牌:
- 萃园生物
- 产地:
- 湖北武汉
- 保存条件:
- 2-8℃冷藏、干燥、密封、避光
- 纯度规格:
- 98% 以上HPLC
- 产品类别:
- 黄酮类
- 提取来源:
- 1 Alpinia sp. 2 Arnica sp. 3 Eupatorium sp. 4 Geranium sp. 5 Gossypium sp. 6 Phyllanthus sp.
公司简介
湖北萃园生物科技有限公司是一家集研发、生产、销售于一体的国际性高技术企业,主要从事高纯度中药化学成分、中药对照品、高品质提取物、天然产物中间体以及药物杂质等的生产、定制和生产工艺开发。专注于天然产物在医药,食品,日化等大健康领域的开发和应用以及中药物质基础研究和中药质量标准国际化;服务于全球科研机构、高校和各种终端客户。
经过几年的艰苦摸索和奋斗创新,萃园生物已在对照品和植化产品市场站稳脚跟并逐年扩大市场份额。公司本着专业诚信,互利双赢的原则与广大客户和同行真诚合作。
凭着优异的品质和良好的服务,目前我们的客户已遍布全球多个国家和地区。是多家大公司的稳定供应商;在草药质量标准和标准品研究及供应方面建立了良好的合作关系。
我们致力于为客户提供专业优质的服务,高质量的产品和有竞争力的价格。我们的宗旨:诚信、优质、专业、高效。
我们的特色服务如下:
1. 中药化学成分及对照品(标准品)的定制研发和生产
2. 中药化学成分的工业化高效分离及分离纯化工艺解决方案
3. 新药研发用天然产物中间体及其衍生物,药物杂质的定制分离
4. 新药筛选用中药化学成分化合物库(为药理学研究,抑制剂,生物活性筛选等提供超过2200种中药成分的化合物实体库)
| 成立日期 | (3年) |
| 注册资本 | 伍佰万圆人民币 |
| 员工人数 | 10-50人 |
| 年营业额 | ¥ 300万-500万 |
| 经营模式 | 贸易,工厂,试剂,定制,服务 |
| 主营行业 | 中间体,天然产物,医药中间体,中草药提取物,技术服务 |
山奈素相关厂家报价 更多
-

- 山奈素 491-54-3
- 卓瑞宁(上海)科技有限公司 VIP
- 2026-02-12
- 询价
-

- 山奈素
- 成都彼样生物科技有限公司 VIP
- 2026-02-10
- 询价
-

- 山奈素
- 南京道斯夫生物科技有限公司 VIP
- 2026-02-09
- 询价
-
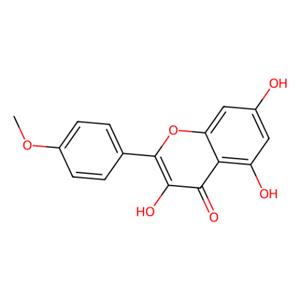
- 山奈素(CAS:491-54-3)
- 上海纯优生物科技有限公司 VIP
- 2026-01-19
- ¥100
-

- 山奈素|T3806|TargetMol
- 上海陶术生物科技有限公司 VIP
- 2026-01-06
- ¥288
-
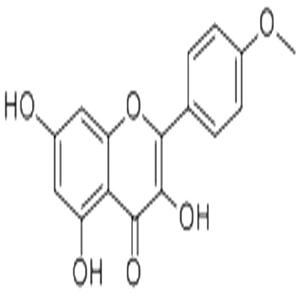
- aladdin 阿拉丁 K424252 山奈素 491-54-3 10mM in DMSO
- 上海阿拉丁生化科技股份有限公司 VIP
- 2025-11-14
- ¥212.90
-
- 山奈素
- 上海嘉定区澄浏公路52号
- 2025-11-06
- 询价
-
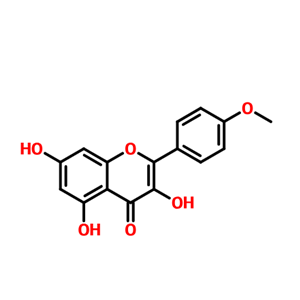
- 山奈素
- 陕西缔都医药化工有限公司 VIP
- 2025-09-11
- 询价
-

- CRM鸿蒙标准物质/甲醇中山奈素溶液标准物质
- 北京海岸鸿蒙标准物质技术有限责任公司 VIP
- 2025-08-05
- 询价
-
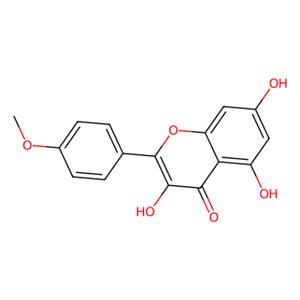
- aladdin 阿拉丁 K107695 山奈素 491-54-3 分析标准品,≥98%
- 上海阿拉丁生化科技股份有限公司 VIP
- 2025-05-16
- ¥212.90