| CAS 编号 | 82854-37-3 | SDF | 下载 SDF |
| PubChem 编号 | 5281771 | 外观 | 白米色粉末 |
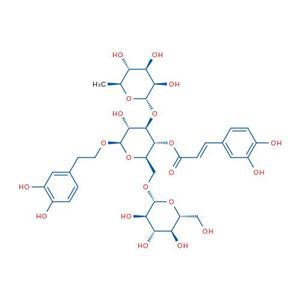
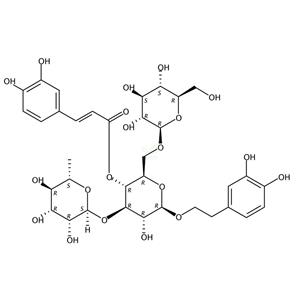
| 公式 | C35H46O20 | M.Wt | 786.72 |
| 化合物的种类 | 苯丙素类 | 存储 | 在 -20°C 下干燥 |
| 溶解度 | DMSO:≥ 100 mg/mL (127.11 mM)
*“≥”表示可溶,但饱和度未知。 |
| 英文名称 | [(2R,3R,4R,5R,6R)-6-[2-(3,4-二羟基苯基)乙氧基]-5-羟基-2-[[(2R,3R,4S,5S,6R)-3,4,5-三羟基-6-(羟甲基)氧杂环英-2-基]氧甲基]-4-[(2S,3R,4R,5R,6S)-3,4,5-三羟基-6-甲基氧杂环英-2-基]氧氧杂环英-3-基](E)-3-(3,4-二羟基苯基)丙-2-烯酸酯 |
| SMILES | CC1C(C(C(O1)OC2C(C(OC(C2OC(=O)C=CC3=CC(=C(C=C3)O)O)COC4C(C(C(C(O4)CO)O)O)OCC5=CC(=C(C=C5)O)O)O)O)O |
| 标准 InChIKey | FSBUXLDOLNLABB-ISAKITKMSA-N |
| 标准 InChI | InChI=1S/C35H46O20/c1-14-24(42)26(44)29(47)35(51-14)55-32-30(48)34(49-9-8-16-3-6-18(38)20(40)11-16)53-22(13-50-33-28(46)27(45)25(43)21(12-36)52-33)31(32)54-23(41)7-4-15-2-5-17(37)19(39)10-15/h2-7, 10-11,14,21-22,24-40,42-48H,8-9,12-13H2,1H3/b7-4+/t14-,21+,22+,24-,25+,26+,27-,28+,29+,30+,31+,32+,33+,34+,35-/m0/s1 |
| 一般提示 | 为了获得更高的溶解度,请在37°C下加热试管,并在超声波浴中摇晃一段时间。储备溶液可在 -20°C 以下储存数月。
我们建议您在同一天准备并使用该溶液。但是,如果测试计划需要,可以提前准备储备溶液,并且必须将储备溶液密封并储存在-20°C以下。一般来说,储备溶液可以保存几个月。
使用前,我们建议您将小瓶在室温下放置至少一个小时,然后再打开它。 |
| 关于包装 | 1.产品的包装在运输过程中可能会反转,导致高纯度化合物粘附在小瓶的颈部或瓶盖上。将滤瓶从包装中取出,轻轻摇晃,直到化合物落到小瓶底部。
2.对于液体产品,请以500xg离心,将液体聚集到小瓶底部。
3.尽量避免实验过程中的损失或污染。 |
| 。 |
松果菊苷的生物活性
| 描述 | 松果菊苷是一种天然的多酚化合物,具有多种药理活性,如抗衰老、抗缺氧、抗癌、抗骨质疏松、抗氧化、抗炎、神经保护、保肝、一氧化氮自由基清除和血管舒张等。松果菊苷可以改善5-FU诱导的骨髓抑制小鼠的骨髓造血功能,它通过抑制核苷酸池消毒酶MTH1诱导凋亡癌细胞死亡。松果菊苷通过激活神经元细胞中的 Trk 细胞外信号调节激酶 (ERK) 通路,抑制由随后的鱼藤酮暴露引起的细胞色素 c 释放和 caspase-3 激活。 |
| 目标 | 罗斯 |PI3K系列 |Trk受体 |半胱天冬酶 |ERK公司 |β-淀粉样蛋白 |高浓度因子 |Bcl-2/Bax - 仅供科研 |CDK公司 |第21页 |
| 体外研究 | Echinacoside 抑制 HEWL 的淀粉样蛋白原纤维化,并防止 Aβ 诱导的神经毒性。[Pubmed: 25193102]国际生物学大分子杂志。2015 1 月;72:243-53.我们研究了松果菊苷对β-淀粉样蛋白(Aβ)诱导的神经毒性的保护作用。通过光谱分析、电子显微镜、细胞活力测定和溶血测定,我们发现松果菊苷剂量依赖性地抑制HEWL聚集,并且这种抑制发生在不同的纤维形成阶段。松果菊苷还可以以浓度依赖性方式清除DPPH和OH自由基。3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)和2',7'-二氯二氢荧光二鲸酸酯(DCFH-DA)荧光测定结果表明,松果菊苷可提高Aβ损伤的大鼠嗜铬细胞瘤PC12细胞的活力,抑制Aβ触发的细胞内活性氧(ROS)增加。本研究结果有助于更好地理解松果菊苷与淀粉样蛋白形成蛋白之间的相互作用,也揭示了松果菊苷对淀粉样蛋白原纤维诱导的神经元细胞死亡的保护作用。 松果菊苷在缺氧条件下对大鼠肺动脉平滑肌细胞的抗增殖作用。[Pubmed:25341567]J Pharmacol Sci. 2014;126(2):155-63.本研究的主要目的是评估松果菊苷(ECH)对缺氧诱导的大鼠肺动脉平滑肌细胞(PASMC)增殖的影响及其机制。
方法和结果:
将PASMCs在常氧(NOR)、缺氧(HYP)、缺氧+0.35 MM ECH(HYP + ECH0.35)或缺氧+0.4 MM ECH(HYP + ECH0.4)下孵育24 h。通过 MTS 测定评估细胞活力。DAPI染色观察细胞凋亡形态,流式细胞术分析量化细胞凋亡。免疫组化法和实时荧光定量PCR法测定Caspase-3活性,实时荧光定量PCR法检测HIF-1α、Bax、Bcl-2和Fas的表达。缺氧诱导PASMCs显著增殖,ECH以浓度依赖性方式抑制PASMCs。这与PASMCs的凋亡有关。Z-DEVD-FMK可以部分降低ECH的抑制作用;HYP+ECH0.4和HYP+ECH0.35组caspase-3蛋白和基因表达量显著高于HYP+ECH0.35组。ECH显著提高了Bax和Fas的表达,降低了Bcl-2和HIF-1α的表达。
结论:
ECH可抑制缺氧诱导的大鼠PASMCs增殖,与PASMCs凋亡和缺氧改善有关。ECH 可能是预防和治疗缺氧诱发的 PAH 的潜在药物。 紫锥菊苷通过抑制核苷酸库消毒酶 MTH1 诱导凋亡癌细胞死亡。[Pubmed:26677335 ]Onco瞄准了其他目标。2015 12 月 8;8:3649-64.抑制核苷酸库消毒酶 MTH1 会导致癌细胞中广泛的氧化 DNA 损伤和凋亡,因此可用作抗癌策略。由于天然产物一直是药用化学品的丰富来源,在本研究中,我们使用MTH1催化的酶促反应作为高通量体外筛选试验,以寻找能够抑制MTH1的天然化合物。
方法与结果:
紫锥菊苷是一种源自药用植物肉苁蓉和紫锥菊的化合物,在体外试验中有效抑制了MTH1的催化活性。用紫锥菊苷处理各种人癌细胞系导致细胞氧化鸟嘌呤(8-氧代鸟嘌呤)水平显著升高,而细胞活性氧水平保持不变,表明紫锥菊苷还抑制了细胞MTH1的活性。因此,紫锥菊苷处理诱导了 DNA 损伤标志物的立即和显着增加和 G1/S-CDK 抑制剂 p21 的上调,随后在癌症中显着凋亡细胞死亡和细胞周期停滞,但在非癌细胞中没有。
结论:
综上所述,这些研究将天然化合物确定为MTH1抑制剂,并表明天然产物可以成为抗癌剂的重要来源。 |
| 体内 | 紫锥菊苷通过抑制细胞凋亡和炎症改善D-半乳糖胺加脂多糖诱导的小鼠急性肝损伤。[Pubmed:24797709]Scand J 胃肠病。2014年8月;49(8):993-1000.本研究旨在探讨从中草药肉苁蓉茎中分离出的苯甲菊苷对D-半乳糖胺(GalN)和脂多糖(LPS)诱导的小鼠急性肝损伤的保护作用。
方法和结果:
用紫锥菊苷预处理显着提高了 GalN/LPS 治疗小鼠的存活率并减轻了急性肝毒性,如降低 ALT 水平和改善组织学体征所证明的那样。紫锥菊苷具有抗凋亡和抗炎特性,其特征在于显著抑制肝细胞凋亡和显著减少炎症标志物,包括小鼠血浆中的髓过氧化物酶、细胞外核小体、高迁移率组 box 1 和炎性细胞因子,这可能是与其保护作用相关的重要机制。
结论:
我们的研究结果表明,紫锥菊苷可以对 GalN/LPS 诱导的小鼠急性肝损伤提供显着的保护,这可能补充临床环境中治疗急性肝损伤的可用策略。 松果菊苷改善5-FU诱导的骨髓抑制小鼠的造血功能。[Pubmed:25623854]生命科学. 2015 2 月 15;123:86-92.本研究旨在探讨松果菊苷(Echinacoside,ECH)对5-FU诱导的骨髓抑制小鼠造血功能的影响。
方法和结果:
在体外,用ECH刺激后,分别通过CCK8法和形态学评估骨髓抑制小鼠的骨髓(BM)细胞和骨髓基质细胞(BMSC)的增殖能力。在体内,将5-FU诱导的骨髓抑制或对照小鼠每天用15mg / kg的ECH或等体积的生理盐水胃内给药12天,然后分离BM细胞进行集落形成细胞测定。同时,培养BMSCs4周后观察细胞生长模式,收集细胞培养上清液进行GM-CSF分泌,提取细胞RNA进行EPO和GM-CSF RT-PCR。收集用 ECH 刺激 24 小时或 48 小时的 BM 细胞或 BMSC 用于蛋白质提取和蛋白质印迹。 ECH 刺激了 BM 细胞的生长,但不刺激源自 5-FU 处理小鼠的 BMSC。在5-FU处理的小鼠中,胃内给药ECH可以增加总造血祖细胞和GM祖细胞的数量至健康对照小鼠水平,但不能增加BFU祖细胞的数量。来自ECH处理的骨髓抑制小鼠的BMSCs生长更旺盛,表达更多的GM-CSF,但EPO不明显。ECH激活了5-FU抑制的BM细胞中的PI3K信号通路。
结论:
ECH可改善5-FU诱导的骨髓抑制小鼠骨髓造血功能。ECH 可被视为化疗或 HSC 移植期间患者的替代有效疗法。 |
松果菊苷的议定书
| 激酶测定 | 短暂暴露于松果菊苷足以激活 Trk 信号传导并保护神经元细胞免受鱼藤酮的侵害。[Pubmed:23189969]J 神经化学。2013年2月;124(4):571-80.神经营养因子主要通过Trk受体发挥其生理功能,神经营养信号网络对神经元的存活至关重要。然而,神经营养因子在治疗神经退行性疾病中的治疗使用受到许多药理学挑战的阻碍,其中最重要的挑战是它们被输送到中枢神经系统。在这里,我们报道了松果菊苷是一种小型天然化合物,通过激活 Trk 受体及其下游信号通路来引发神经保护。松果菊苷是肉苁蓉草药的主要活性成分,肉苁蓉草药是一种广泛使用的中草药,具有神经保护作用。
方法和结果:
我们在这项研究中表明,短暂暴露于松果菊苷足以保护用 TrkA 或 TrkB 过度表达的神经元细胞和非神经元细胞免受鱼藤酮损伤。对潜在机制的进一步研究表明,紫锥菊苷瞬时处理通过激活神经元细胞中的 Trk-细胞外信号调节激酶 (ERK) 通路抑制随后的鱼藤酮暴露引起的细胞色素 c 释放和 caspase-3 激活。
结论:
由于紫锥菊苷能够自由穿过血脑屏障,因此在神经退行性疾病治疗中具有广阔的潜力。 |
| 细胞研究 | 紫锥菊苷延缓人成纤维细胞MRC-5的细胞衰老。[Pubmed:20099521]紫锥菊苷通过减少 ROS 的产生来防止 6-羟基多巴胺诱导的 PC12 细胞线粒体功能障碍和炎症反应。[Pubmed:25788961]基于 Evid 的补体 Alternat Med. 2015;2015:189239.帕金森病 (PD) 是一种神经退行性疾病,其特征是黑质处多巴胺能 (DA) 神经元进行性丢失。线粒体功能障碍和炎症反应参与PD细胞损伤的机制。 6-羟基多巴胺(6-OHDA)是一种多巴胺类似物,特异性损伤多巴胺能神经元。紫锥菊苷(ECH)是一种从肉苁蓉茎中分离得到的苯乙醇糖苷,在以前的研究中显示出多种神经保护作用。 本研究旨在探讨其对6-OHDA诱导的PC12细胞神经毒性的影响及可能的机制。
方法和结果:
结果表明: 与未处理的 PC12 细胞相比,6-OHDA 降低了细胞活力, 降低了氧化还原活性, 降低了线粒体膜电位, 并诱导了线粒体介导的凋亡.然而,松果菊苷处理显着减弱了6-OHDA诱导的这些变化。此外,松果菊苷还可以显著缓解6-OHDA诱导的炎症反应。进一步的研究表明,松果菊苷可以减少6-OHDA诱导的PC12细胞中ROS的产生。
结论:
这些结果表明,松果菊苷对6-OHDA诱导的神经毒性的潜在机制可能涉及通过减少ROS产生来减轻线粒体功能障碍和炎症反应。 药剂师。2009年11月;64(11):752-4.在这项研究中,研究了从中国传统草药肉苁蓉茎中分离出的苯乙醇之一松果菊苷对人胚胎肺成纤维细胞MRC-5细胞的影响。
方法和结果:
用Alamar Blue评估细胞增殖活性,表明用松果菊苷处理可以延缓衰老。流式细胞术结果显示,松果菊苷可触发G1期细胞进入S期和G2期,并可改善ROS降解。彗星测定结果表明,松果菊苷可以保护细胞免受DNA损伤,部分阐明了其作用机制。
结论:
以上结果表明松果菊苷具有潜在的抗衰老活性。 |
| 动物研究 | 松果菊苷在大鼠骨质减少模型中的疗效和安全性。[Pubmed:23573159 ]基于Evid的补体Alternat Med. 2013;2013:926928.本研究旨在采用骨质减少大鼠模型探讨松果菊苷(Echinacoside,ECH)的疗效和安全性。
方法和结果:
将48只6月龄雌性Sprague-Dawley大鼠随机分为1个假手术组(SHAM)和5个OVX(卵巢切除术)亚组:载体0.5%羧甲基纤维素钠(0.5%CMC-Na)和OVX载体(OVX),OVX载体17 β雌二醇(E2)和OVX分级剂量(ECH-L、ECH-M和ECH-H)。检验ECH和E2对血清生化参数、骨密度(BMD)、骨生物力学特性、骨微结构和免疫组化的影响,并评价安全性评估。结果显示,与OVX组相比,ECH治疗改善了股骨总骨密度、骨微结构和生物力学性能,降低了血清标志物水平。此外,ECH给药显著提高血清中骨保护素(OPG)水平,降低血清和股骨近端核因子κB配体受体激活因子(RANKL)水平。重要的是,与OVX和SHAM组相比,ECH治疗改善了脂质参数,而子宫和乳腺不良事件的总体发生率却没有降低。
结论:
本研究表明,给予 ECH 12 周可以通过增加 OPG/RANKL 比率有效安全地预防 OVX 诱导的大鼠骨质疏松症。 |
制备松果菊苷的储备溶液
| 1 毫克 | 5 毫克 | 10 毫克 | 20 毫克 | 25 毫克 |
| 1毫米 | 1.2711毫升 | 6.3555毫升 | 12.711毫升 | 25.422毫升 | 31.7775毫升 |
| 5毫米 | 0.2542毫升 | 1.2711毫升 | 2.5422毫升 | 5.0844毫升 | 6.3555毫升 |
| 10 米 | 0.1271毫升 | 0.6356毫升 | 1.2711毫升 | 2.5422毫升 | 3.1778毫升 |
| 50毫米 | 0.0254毫升 | 0.1271毫升 | 0.2542毫升 | 0.5084毫升 | 0.6356毫升 |
| 100毫米 | 0.0127毫升 | 0.0636毫升 | 0.1271毫升 | 0.2542毫升 | 0.3178毫升 |
| *注意:如果 你正在实验过程中,有必要做出 样品的稀释率。以上稀释数据 仅供参考。通常,它可以变得更好 在较低浓度内的溶解度。 |
松果菊苷的背景
松果菊苷是一种天然的多酚化合物,具有多种药理活性,如抗氧化、抗炎、神经保护、保肝、一氧化氮自由基清除和血管舒张等。 IC50值: 目标: 体外研究:松果菊苷(ECH)剂量依赖性地抑制HEWL聚集,且这种抑制发生在不同的纤维形成阶段。ECH还可以以浓度依赖性方式清除DPPH和OH自由基。ECH可以提高Aβ损伤的大鼠嗜铬细胞瘤PC12细胞的活力,并抑制Aβ引发的细胞内活性氧(ROS)的增加[1]。用松果菊苷瞬时处理通过激活神经元细胞中的Trk-细胞外信号调节激酶(ERK)通路,抑制细胞色素c释放和caspase-3激活,这是由随后的鱼藤酮暴露引起的[2]。在0.01-10nmol· 浓度范围内,ECH显著增加成骨细胞增殖、ALP活性、COL I含量、OCN水平和矿化增强。L(-1) (p<0.05),表明ECH对成骨细胞骨形成有刺激作用,或对骨质疏松症有潜在的活性[4]。 体内研究:在OVX大鼠中,ECH处理可显著逆转体重、血清羟脯氨酸(HOP)水平的增加以及子宫湿重和BMD的降低[3]。紫锥菊苷(60mg / kg)在GalN / LPS暴露前1小时腹膜内给予小鼠。用紫锥菊苷预处理显着提高了GalN / LPS处理的小鼠的存活率并减轻了急性肝毒性,如ALT水平降低和组织学体征改善所证明的那样。紫锥菊苷具有抗凋亡和抗炎特性,其特征是显著抑制肝细胞凋亡,显著降低小鼠血浆中的髓过氧化物酶、细胞外核小体、高迁移率组1和炎性细胞因子等炎症标志物,这可能是与其保护作用相关的重要机制[5]。
参考文献:
[1]. Zhang D, et al.Echinacoside 抑制 HEWL 的淀粉样蛋白原纤维化,并防止 Aβ 诱导的神经毒性。国际生物学大分子杂志。2014年9月2日;72C:243-253。 [2]. 朱明, 等.短暂暴露于松果菊苷足以激活 Trk 信号传导并保护神经元细胞免受鱼藤酮的侵害。J 神经化学。2013年2月;124(4):571-80. [3]. 李芳, et al.紫锥菊苷在卵巢切除大鼠中的抗骨质疏松活性。植物医学。2013年4月15日;20(6):549-57. [4]. 李芳, et al.紫锥菊苷通过增加 MC3T3-E1 细胞中的 OPG/RANKL 比率来促进骨再生。Fitoterapia。2012年12月;83(8):1443-50. [5]. 李旭, 等.紫锥菊苷通过抑制细胞凋亡和炎症改善D-半乳糖胺加脂多糖诱导的小鼠急性肝损伤。Scand J 胃肠病。2014年8月;49(8):993-1000.