中文名:PMA(叠氮溴化丙锭), 20 mM in water
英文名:PMA (propidium azide bromide), 20 mm in water
货号:P598082
包装:100μl
存储温度:避光,-20°C储存
产品介绍:
PMA是一种高亲和性的DNA结合染料,该染料本身具有微弱的荧光,但与核酸结合后可以发出更为明亮的荧光。它尤其与双链DNA具有高亲和性。PMA不具有细胞膜渗透性,因此可选择性地修饰膜受损的死细胞的 DNA。PMA修饰的DNA经蓝光(~464 nm)光解后,PMA上的光反应性叠氮基转化为高反应性氮烯自由基,与DNA结合位点附近的任何烃部分反应形成稳定的共价氮碳键,从而导致永久性 DNA 修饰(图1)。该修饰过程会使DNA不溶,并使其在随后的基因组DNA提取过程中与细胞碎片一起丢失,进而阻碍死细胞中目标DNA的PCR扩增。残留在溶液中未结合的PMA,在强光照射下与水分子反应分解成无交联活性的羟胺化合物,使羟胺不再能够共价结合DNA,从而不影响PCR扩增。这个特性使得 PMA 可以通过实时定量 PCR(qPCR)的手段,检测多种样本类型包括:细菌、生物膜、酵母、真菌、病毒和真核细胞;与qPCR、NGS、Sanger测序和LAMP技术相结合,广泛应用在食品和水安全和环境测试中。

产品参数:
橙红色液体; Ex (pH 3) = 464 nm (before photolysis); Ex /Em (after photocrosslinking to nucleic acid) = 510/610 nm
注意事项:
1. 使用前请将产品瞬时离心至管底,再进行后续实验。 2. 试剂盒组分中含有荧光染料,使用及保存过程中注意避光。 3. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
应用范围:
细菌核酸染色
使用方法:
使用前注意事项:
1. PMA 根据细胞膜通透性区分死菌和活菌。许多杀死细菌的方法会导致细胞膜受损,因此适用于 PMA 检测。 但有些方法,如紫外线照射,可能不会立即导致细胞膜破裂。因此,在选择 PMA 检测之前,需先进行文献检索和预实验确定是否适用于您选择的细菌类型和杀伤方法。
2. PMA 处理完细菌后需要进行光解,以使染料与死细胞 DNA 共价结合。光解操作可以使用蓝色或白色光源。一般来说,灯越亮,光解步骤的效率就越高。非 LED 灯(如卤素灯)可能会加热您的样本并对分析产生负面影响,照射时需要使用冰块对样品降温处理。
3. 样本可以在光解后冷冻保存。若在进行 PMA 处理光解之前冷冻样本可能会损坏细胞膜并产生假阴性结果。如需在检测之前冷冻样本,建议先进行预实验。
4. PMA 的部分作用机制是通过沉淀从样本中去除 PMA 共价修饰的 DNA;因此,在提取基因组 DNA 时,需使用相同体积的基因组 DNA 洗脱液,进行体积归一化处理。阳性对照可以使用活细胞的基因组 DNA。
5. 为了验证 PMA 在测试样本中的有效性,可对比同处理样本-/+PMA 之间的 Ct (dCt)变化。
实验材料(自备):
①光源(用于 PMA 修饰 DNA 后的光解步骤);②细菌基因组 DNA 提取试剂盒;③配套的 qPCR Mix 试剂盒;④对应样本类型的有效 qPCR 引物;
实验步骤:

1. 吸取 10 μL 菌液于液体 LB 培养基,在细菌培养箱中培养过夜或更长时间,使细菌培养至对数生长期(OD600 ≈ 1.0);
注:培养基类型及培养时间根据实验调整。
2. 取活细菌两份,每份 400 μL,置于干净离心管中。
3. (建议)制备死细菌。若需要死细菌作为对照,可将活细菌放入水浴锅中 95℃加热 5 min,或 58℃加热 3 h,具体操作根据样本类型自行选择,即可获得死细菌。死细菌的后续操作同活细菌。
4. 两份活细菌,一份不用 PMA 处理,一份用 25 μM PMA 处理(处理不同类型或不同来源细菌的最适 PMA 浓度需查阅相关文献)。
5. 将 PMA 处理的样本室温置于摇床上,避光孵育 10 min,使染料与样本充分混匀。
6. 将样品曝光,可以使用蓝色或白色光源,照射时间需自行摸索。例如,可用 60 W 的蓝光灯,照射 15 min。
注:① 若使用卤素灯,我们建议将 PMA 处理的样本管放在距离光源 20 cm 处的冰块上。冰块应放在透明托盘中,调整光源使其直接指向样品,光解 5-15 min;② 若直接用环境中获取的细菌进行实验,由于环境样本的复杂性或浑浊度,需适当延长光解时间。
7. 处理和未处理的活细菌 5000 ×g,离心 10 min,去上清。
8. 根据样本类型选择合适的基因组 DNA 提取试剂盒,洗脱 DNA 时,各组样本使用相同的洗脱体积。
注:DNA 提取步骤参考所用试剂盒的说明书。PMA 的部分作用机制是通过沉淀从样品中去除 PMA 结合的 DNA;因此,在提取基因组 DNA 时,各组应使用相同体积的基因组 DNA 洗脱液,进行体积归一化处理(死菌和活菌提取基因组 DNA 量不一致,因此两者浓度相差明显)。
9. 按如下体系制备反应混合液:
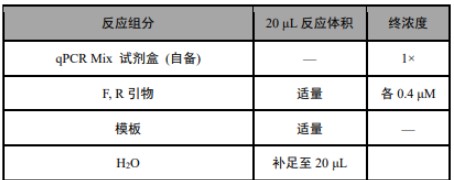
注:① 商用 DNA 提取试剂盒提取的 DNA,qPCR 模板以 2 μL 作为起始优化体积;② 模板体积不得超过最终反应体积的10%;③ 模板浓度:gDNA 做模板时,通常 1-10 ng 即可;④ PCR 引物的终浓度通常为 0.4 μM,可以得到较好的结果,反应性能较差时,可以在 0.2 - 1 μM 范围内调整引物浓度。
10. 轻轻涡旋混匀反应混合液,转移固定体积至 PCR 管。
11. 测试程序(根据自备 qPCR Mix 试剂盒程序进行程序设定)。
12. 数据分析
使用活细菌和死细菌作为对照,分析计算样本中活细胞数。建议开始 PMA qPCR 活细菌检测前,先验证引物及 PCR 程序是否合适。死、活细菌对照 dCt 计算
(1) qPCR 结束后,使用仪器软件计算每个样本的 Ct 值。
(2) 通过计算每个对照细菌的 dCt 的方式,判断 PMA 是否成功抑制了死细菌 DNA 的扩增,计算如下:
dCt 活 = Ct(活, PMA 处理) - Ct(活, PMA 未处理)
dCt 死 = Ct(死, PMA 处理) - Ct(死, PMA 未处理)
(3) 活细菌的 dCt 期望值接近于 0 ± 1,这表明 PMA 不会影响活细胞 DNA 的扩增;
(4) 死细菌的 dCt 期望值大于 4(dCt 为 4 表示减少了约 16 倍,即去除了 94% 的死细菌 DNA;dCt 为 8 表示减少了约250 倍,即去除了 99.6%的死细菌 DNA)。
(5) 死细菌的 dCt 取决于许多因素,包括:菌株系/细胞类型;细菌被杀死方式;PMA 使用浓度;扩增序列长度。
13. 活细菌占比计算
如果死、活细菌对照结果正常,可以进入样本中活细菌占比计算。
(1) 计算样本的 dCt 值:
dCt 样本 = Ct(样本, PMA 处理) - Ct(样本, PMA 未处理)
(2) 转换 dCt 值为活细菌比例:
PMA 抑制倍数 = 2(样本 dCt)
活细菌% = 100 / PMA 抑制倍数
14. 计算活细菌的绝对数量
如果想计算样本中活细菌的绝对数量☆,需要用已知数量的目标菌的基因组 DNA 制作标准曲线。建议稀释的几组基因组浓度在 qPCR 分析体系的范围内。
(1) 以 Ct 值为纵坐标,细胞数为横坐标,制作标准曲线。
(2) 计算实验样本的拷贝数:
Ct = 斜率 * 细胞数 + y 轴截距 (y = mx + b)
细菌数样本 = (Ct – y 轴截距) / 斜率
注:纯化过程中活细菌 DNA 未损失。
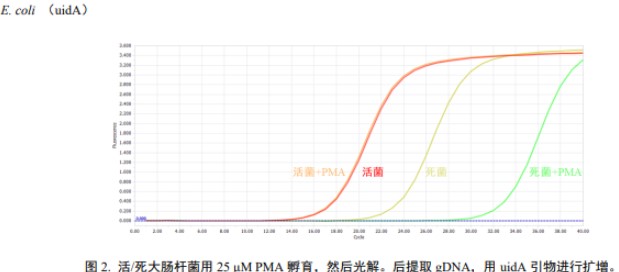
示例:
查看阿拉丁官网此产品相关对应页面:https://www.aladdin-e.com/zh_cn/P598082.html