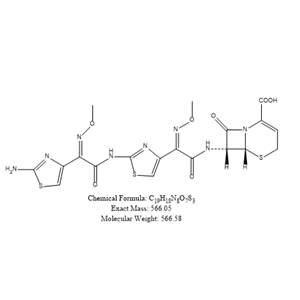
化合物简介
化学式:C13H12N5NaO5S2
分子量:405.385
CAS号:68401-82-1
外观:白色至淡黄色结晶性粉末
药品简介
药理毒理
对大肠埃希菌、肺炎克雷伯菌、奇异变形杆菌等肠杆菌科细菌有强大抗菌作用,铜绿假单胞菌等假单胞菌属和不动杆菌属对该品敏感性差。头孢唑肟对流感嗜血杆菌和淋病奈瑟球菌有良好抗菌作用。该品对金黄色葡萄球菌和表皮葡萄球菌的作用较第一、第二代头孢菌素为差,耐甲氧西林金黄色葡萄球菌和肠球菌属对该品耐药,各种链球菌对该品均高度敏感。消化球菌、消化链球菌和部分拟杆菌属等厌氧菌对该品多呈敏感,艰难梭菌对该品耐药。该品作用机制为该品通过抑制细菌细胞壁粘肽的生物合成而达到杀菌作用。
药代动力学
肌内注射该品0.5g或1.0g后血药峰浓度(cmax)分别为13.7mg/L和39mg/L,于给药后1小时到达。静脉注射该品2g或3g,5分钟后血药峰浓度(cmax)分别为131.8mg/L和221.1mg/L。头孢唑肟广泛分布于全身各种组织和体液中,包括胸水、腹水、胆汁、胆囊壁、脑脊液(脑膜有炎症时)、前列腺液和骨组织中均可达治疗浓度。蛋白结合率30%。该品血消除半衰期(t1/2)为1.7小时。在体内不代谢,24小时内给药量的80%以上以原形经肾排泄,因此尿液中药物浓度高。丙磺舒可使头孢唑肟的肾清除减少,血药浓度增高。
适应症
敏感菌所致的下呼吸道感染、尿路感染、腹腔感染、盆腔感染、败血症、皮肤软组织感染、骨和关节感染、肺炎链球菌或流感嗜血杆菌所致脑膜炎和单纯性淋病。
用法用量
1.成人常用量:一次1~2g,每8~12小时1次;严重感染者的剂量可增至一次3~4g,每8小时1次。治疗非复杂性尿路感染时,一次0.5g,每12小时1次。
2.6个月及6个月以上的婴儿和儿童常用量:按体重一次50mg/kg,每6~8小时1次。
3.肾功能损害者:肾功能损害的患者需根据其损害程度调整剂量。在给予0.5~1g的首次负荷剂量后,肾功能轻度损害的患者(内生肌酐清除率Clcr为50~79ml/分钟)常用剂量为一次0.5g,每8小时1次,严重感染时一次0.75~1.5g,每8小时1次;肾功能中度损害的患者(Clcr为5~49ml/分钟)常用剂量为一次0.25~0.5g,每12小时1次,严重感染时一次0.5~1g,每12小时1次;肾功能重度损害需透析的患者(Clcr为0~4ml/分钟)常用剂量为一次0.5g,每48小时1次或一次0.25g,每24小时1次,严重感染时一次0.5~1g,每48小时1次或一次0.5g,每24小时1次。血液透析患者透析后可不追加剂量,但需按上述给药剂量和时间,在透析结束时给药。该品可用注射用水、氯化钠注射液、5%葡萄糖注射液溶解后缓慢静脉注射,亦可加在10%葡萄糖注射液、电解质注射液或氨基酸注射液中静脉滴注30分钟~2小时。
不良反应
1、皮疹、瘙痒和药物热等过敏反应、腹泻、恶心、呕吐、食欲不振等。
2、碱性磷酸酶、血清氨基转移酶轻度升高、暂时性血胆红素、血尿素氮和肌酐升高等。
3、贫血(包括溶血性贫血)、白细胞减少、嗜酸性粒细胞增多或血小板减少少见。
4、偶见头痛、麻木、眩晕、维生素K和维生素B缺乏症、过敏性休克。
5、极少数病人可发生黏膜念珠菌病。
6、注射部位烧灼感、蜂窝织炎、静脉炎(静脉注射者)、疼痛、硬化和感觉异常等。
禁忌
1、对该品及其他头孢菌素过敏者禁用。
2、对青霉素过敏者慎用。
3、本人或父母、兄弟中有易发生支气管哮喘、皮疹、荨麻疹等过敏体质慎用。
4、有高度肾损害的患者、对进食困难、或非经口营养患者、全身状态低下的患者、高龄患者均须慎用。
注意事项
1、拟用该品前必须详细询问患者先前有否对该品、其他头孢菌素类、青霉素类或其他药物的过敏史,因为在青霉素类和头孢菌素类等β内酰胺类抗生素之间已证实存在交叉过敏反应。在青霉素类抗生素过敏患者中约5%~10%可对头孢菌素出现交叉过敏反应。因此有青霉素类过敏史患者,有指征应用该品时,必须充分权衡利弊后在严密观察下慎用。如以往发生过青霉素休克的患者,则不宜再选用该品。如应用该品时,一旦发生过敏反应,需立即停药。如发生过敏性休克,需立即就地抢救,给予肾上腺素、保持呼吸道通畅、吸氧、糖皮质激素及抗组胺药等紧急措施。
2、对诊断的干扰:抗球蛋白(Coombs)试验可出现阳性。用Benedict、Fehling及Clinitest试剂检查尿糖可呈假阳性。血清碱性磷酸酶、血尿素氮、丙氨酸氨基转移酶、门冬氨酸氨基转移酶或血清乳酸脱氢酶值可增高。
3、几乎所有的抗生素都可引起假膜性肠炎,包括头孢唑肟。如在应用过程中发生抗生素相关性肠炎,必须立即停药,采取相应措施。
4、有胃肠道疾病病史者,特别是结肠炎患者应慎用。易发生支气管哮喘、皮疹、荨麻疹等过敏性体质者慎用。不能很好进食或非经口摄取营养者、高龄者、恶液质等患者应慎用,因为有出现维生素K缺乏症的情况。
5、虽然该品未显示出对肾功能的影响,应用该品时仍应注意肾功能,特别是在那些接受大剂量治疗的重症病人中。
6、与其他抗生素相仿,过长时间应用该品可能导致不敏感微生物的过度繁殖,需要严密观察,一旦发生二重感染,需采取相应措施。
7、一次大剂量静脉注射时可引起血管痛、血栓性静脉炎,应尽量减慢注射速度以防其发生。
8、该品溶解后在室温下放置不宜超过7小时,冰箱中放置不宜超过48小时。
用药安全
1、孕妇及哺乳期妇女用药:
动物实验中没有发现该品对生殖能力和胎儿有损害,但妊娠期用药的安全性尚不清楚,孕妇只在有明确指征时应用。该品有少量可分泌至乳汁中,哺乳期妇女应用该品时应暂停哺乳。
2、儿童用药:6个月以下小儿使用该品的安全性和有效性尚未确定。
3、老年用药:老年患者常伴有肾功能减退,应适当减少剂量或延长给药间期。
副作用
1、过敏反应引起的主要症状是皮疹、荨麻疹、瘙痒、红斑及药物热等,对药物有过敏史者要慎用。必要时可作皮试。
2、胃肠道反应如恶心、呕吐、腹泻等。
3、静注1次大量,可引起血管痛及血栓性静脉炎,故宜减慢注射速度。
4、可发生眩晕、头痛等反应。
药物相互作用
与香豆素类药合用时,有增强香豆素类药作用的可能;有与呋喃苯氨酸等利尿药、其他头孢菌素与氨基糖苷类抗生素联合应用时出现肾毒性的报道。
药典信息
基本信息
本品为(6R,7R)-7-[2-(2-氨基噻唑-4-基)-2-(甲氧亚氨基)乙酰氨基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸钠盐,按无水物计算,含头孢唑肟(C13H19N5O5S2)应为92.5%~96.5%。
性状
本品为白色至淡黄色结晶、结晶性或颗粒状粉末,无臭或有微臭,略有引湿性。
本品在水中极易溶解,在甲醇中极微溶解,在乙醇和丙酮中几乎不溶。
比旋度
取本品,精密称定,加水溶解并定量稀释制成每1mL中约含10mg的溶液,依法测定(通则0621),比旋度为+125 至+145°。
吸收系数
取本品,精密称定,加水溶解并定量稀释制成每1mL中约含10µg的溶液,照紫外-可见分光光度法(通则0401),在235nm的波长处测定吸光度,吸收系数(E1%1cm)为410~450。
鉴别
1、照薄层色谱法(通则0502)试验。
供试品溶液:取本品适量,加磷酸盐缓冲液(pH7.0)5mL振摇使溶解,用75%乙醇稀释制成每1mL中约含5mg的溶液。
对照品溶液:取头孢唑肟对照品适量,加磷酸盐缓冲液(pH7.0)5mL振摇使溶解,用75%乙醇稀释制成每1mL中约含5mg的溶液。
系统适用性溶液:取头孢唑肟对照品与头孢拉定对照品适量,加磷酸盐缓冲液(pH7.0)使溶解,用75%乙醇稀释制成每1mL中各约含5mg的溶液。
色谱条件:采用硅胶GF254薄层板,以乙酸乙酯-乙醚-二氯甲烷-甲酸(5:4:5:6)为展开剂。
测定法:吸取上述三种溶液各2µL,分别点于同一薄层板上,展开,晾干,置紫外光灯(254nm)下检视或置碘蒸气中显色。
系统适用性要求:系统适用性溶液应显两个清晰分离的斑点。
结果判定:供试品溶液所显主斑点的位置和颜色应与对照品溶液主斑点的位置和颜色相同。
2、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
3、本品红外光吸收图谱应与对照的图谱(光谱集723图)一致。
4、本品显钠盐鉴别1的反应(通则0301)。
以上1、2两项可选做一项。
检查
结晶性
取本品,依法测定(通则0981),应符合规定。
酸碱度
取本品,加水制成每1mL中含头孢唑肟0.1g的溶液,依法测定(通则0631),pH值应为6.0~8.0。
溶液的澄清度与颜色
取本品5份,各0.60g,分别加水5mL溶解后,溶液应澄清无色,如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓,如显色,与黄色或黄绿色6号标准比色液(通则0901第一法)比较,均不得更深。
有关物质
照高效液相色谱法(通则0512)测定。
pH7.0磷酸盐缓冲液:取磷酸二氢钾3.63g、磷酸氢二钠14.33g,加水溶解并稀释至1000mL。
供试品溶液:取本品适量,加pH7.0磷酸盐缓冲液溶解并稀释制成每1mL中约含1.5mg的溶液。
对照溶液:精密量取供试品溶液适量,用pH7.0磷酸盐缓冲液定量稀释制成每1mL中约含3µg的溶液。
灵敏度溶液:精密量取对照溶液适量,用pH7.0磷酸盐缓冲液定量稀释制成每1mL中约含0.75µg的溶液。
系统适用性溶液(1):取头孢唑肟钠约15mg,置10mL量瓶中,加0.1mol/L氢氧化钠溶液1mL,放置30分钟,用pH7.0磷酸盐缓冲液稀释至刻度,摇匀。
系统适用性溶液(2):取头孢唑肟钠适量,加pH7.0磷酸盐缓冲液溶解并稀释制成每1mL中约含0.1g的溶液,放置24小时后,用pH7.0磷酸盐缓冲液稀释制成每1mL中约含1.5mg的溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂(4.6mm×250mm,5µm或效能相当的色谱柱),以pH3.6缓冲液(取枸橼酸1.42g、磷酸氢二钠2.31g,加水溶解并稀释至1000mL)为流动相A,乙腈为流动相B,按下表进行线性梯度洗脱,柱温为40°C,流速为每分钟0.8mL,检测波长为254nm,进样体积20µL。
时间(分钟)
流动相A(%)
流动相B(%)
0
97
3
10
85
15
20
40
60
25
40
60
26
97
3
35
97
3
系统适用性要求:系统适用性溶液(1)的色谱图中,头孢唑肟峰的保留时间约为12~13分钟,头孢唑肟峰与相对保留时间约为0.9的杂质峰之间的分离度应大于6.0。系统适用性溶液(2)的色谱图中,二聚物峰的相对保留时间约为1.3。灵敏度溶液色谱图中,主成分峰高的信噪比应大于10。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度:供试品溶液色谱图中如有杂质峰,二聚物的峰面积不得大于对照溶液主峰面积的0.5倍(0.1%),其他单个杂质峰面积不得大于对照溶液主峰面积的2.5倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的5倍(1.0%)小于灵敏度溶液主峰面积的峰忽略不计。
2-乙基己酸
本品适量,依法测定(通则0873),不得过0.5%。
水分
取本品,照水分测定法(通则0832第一法1)测定,含水分不得过8.5%。
可见异物
取本品5份,每份各2.0g,加微粒检查用水溶解,依法检查(通则0904),应符合规定。(供无菌分装用)
不溶性微粒
取本品,加微粒检查用水制成每1mL中含60mg的溶液,依法检查(通则0903),每1g样品中含10µm及10µm以上的微粒不得过6000粒,含25µm及25µm以上的微粒不得过600粒。(供无菌分装用)
细菌内毒素
取本品,依法检查(通则1143),每1mg头孢唑肟中含内毒素的量应小于0.10EU。(供注射用)
无菌
取本品,用0.1%无菌蛋白胨水溶液溶解并稀释制成每1mL中含40mg的溶液,经薄膜过滤法处理,用0.1%无菌蛋白胨水溶液分次冲洗(每膜不少于600mL),以大肠埃希菌为阳性对照菌,依法检查(通则1101),应符合规定。(供无菌分装用)
含量测定
照高效液相色谱法(通则0512)测定。
pH7.0磷酸盐缓冲液:见有关物质项下。
供试品溶液:取本品适量(约相当于头孢唑肟20mg),精密称定,置200mL量瓶中,加pH7.0磷酸盐缓冲液溶解并稀释至刻度,摇匀。
对照品溶液:取头孢唑肟对照品适量,精密称定,加pH7.0磷酸盐缓冲液溶解并定量稀释制成每1mL中约含头孢唑肟0.1mg的溶液。
系统适用性溶液:称取头孢唑肟对照品5mg,置10mL量瓶中,加0.1mol/L氢氧化钠溶液1mL,放置30分钟,用pH7.0磷酸盐缓冲液稀释至刻度,摇匀,得含约4%头孢唑肟碱降解物的混合溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂(4.6mm×250mm,5µm或效能相当的色谱柱),以pH3.6缓冲液(取枸橼酸1.42g、磷酸氢二钠2.31g,加水溶解并稀释至1000mL)-乙腈(9:1)为流动相,检测波长为254nm,进样体积20µL。
系统适用性要求:系统适用性溶液色谱图中,头孢唑肟的保留时间约为8分钟,头孢唑肟峰与相对保留时间约0.8的碱降解物峰之间的分离度应大于3.0。
测定法:精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算供试品中C13H13N5O5S2的含量。
类别
β-内酰胺类抗生素,头孢菌素类。
贮藏
密封,在凉暗干燥处保存。
制剂
注射用头孢唑肟钠。
安全信息
安全术语
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
眼睛接触后,立即用大量水冲洗并征求医生意见。
风险术语
R36/37/38:Irritating to eyes, respiratory system and skin.
刺激眼睛、呼吸系统和皮肤。
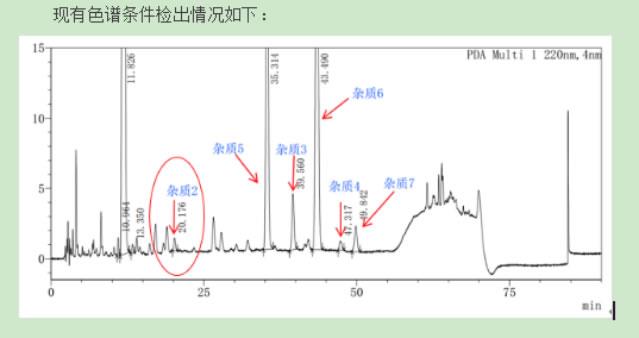
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。