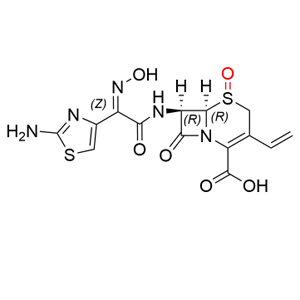
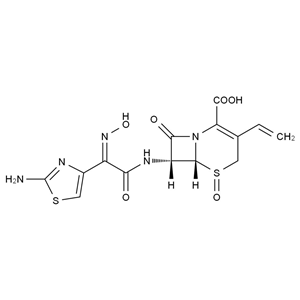
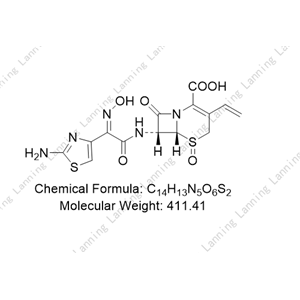
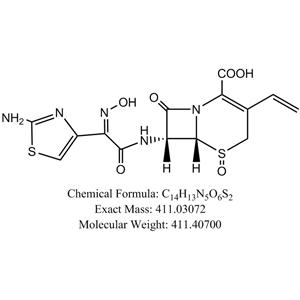
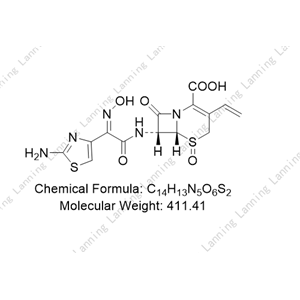
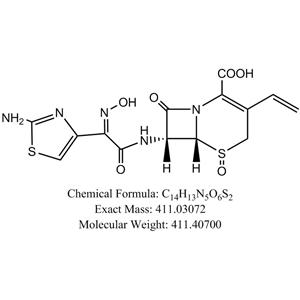
理化性质
密度:1.89g/cm3
熔点:170℃(分解)
折射率:1.862
外观:白色至微黄色结晶性粉末
溶解性:不溶于乙醇、乙醚或水
分子结构数据
摩尔折射率:90.94
摩尔体积(cm3/mol):210.2
等张比容(90.2K):640.0
表面张力(dyne/cm):85.8
极化率(10-24cm3):36.05
计算化学数据
疏水参数计算参考值(XlogP):无
氢键供体数量:4
氢键受体数量:10
可旋转化学键数量:5
互变异构体数量:28
拓扑分子极性表面积:212
重原子数量:26
表面电荷:0
复杂度:739
同位素原子数量:0
确定原子立构中心数量:2
不确定原子立构中心数量:0
确定化学键立构中心数量:1
不确定化学键立构中心数量:0
共价键单元数量:1
药典信息
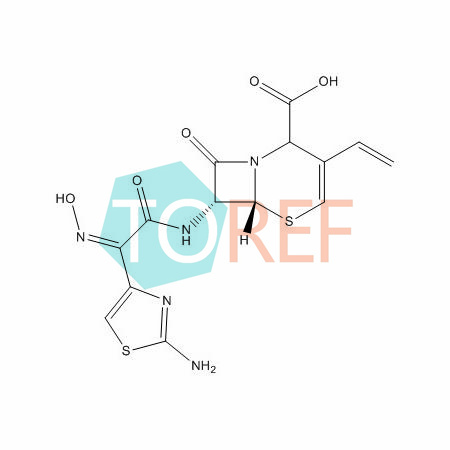
本品为(6R,7R)-7-[[(2-氨基-4-噻唑基)-(肟基)乙酰基]氨基]-3-乙烯基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸,按无水物计算,含头孢地尼(C14H13N5O5S2)不得少于94.0%。
性状
本品为微黄色至黄色结晶性粉末,有微臭。
本品在水、乙醇或乙醚中不溶,在0.1mol/L磷酸盐缓冲液[0.1mol/L磷酸氢二钠溶液-0.1mol/L磷酸二氢钾溶液(2:1)]中略溶。
比旋度
取本品,精密称定,加上述0.1mol/L磷酸盐缓冲液溶解并定量稀释制成每1mL中约含10mg的溶液,依法测定(通则0621),比旋度为-58°至-66°。
吸收系数
取本品,精密称定,加上述0.1mol/L磷酸盐缓冲液溶解并定量稀释制成每1mL中约含10µg的溶液,照紫外-可见分光光度法(通则0401),在287nm波长处测定吸光度,吸收系数(E1%1cm)为570~610。
鉴别
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2、本品的红外光吸收图谱应与对照的图谱(光谱集1122图)一致。
检查
结晶性
取本品少许,依法检查(通则0981),应符合规定。
酸度
取本品约0.2g,加水20mL,使成均匀混悬液,依法测定(通则0631),pH值应为2.5~4.5。
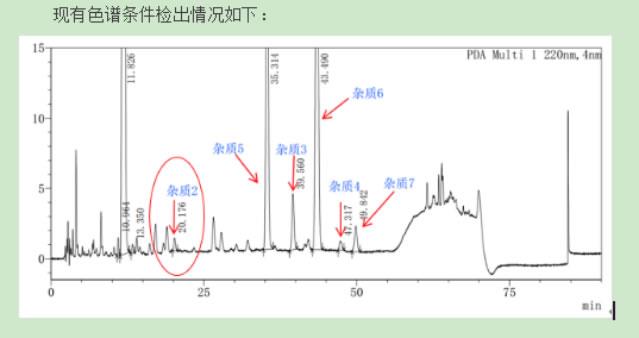
有关物质
照高效液相色谱法(通则0512)测定,避光操作。
供试品溶液:取本品约37.5mg,精密称定,置25mL棕色量瓶中,加上述0.1mol/L磷酸盐缓冲液4mL溶解后,用流动相A稀释至刻度,摇匀。
对照溶液:精密量取供试品溶液1mL,置100mL量瓶中,用流动相A稀释至刻度,摇匀。
系统适用性溶液:取头孢地尼对照品约37.5mg,置25mL棕色量瓶中,加上述0.1mol/L磷酸盐缓冲液4mL溶解后,用流动相A稀释至刻度,摇匀,在水浴中加热约35分钟,放冷,制得每1mL中约含1.5mg的头抱地尼与其降解杂质的混合溶液(其中杂质I、杂质J、杂质K、杂质L的储各约2%)。
灵敏度溶液:精密量取对照溶液适量,用流动相A定量稀释制成每1mL中约含0.75µg的溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,流动相A为0.25%四甲基氢氧化铵溶液(用磷酸调节pH值至5.5)1000mL,加入0.1mol/L乙二胺四醋酸二钠溶液0.4mL,流动相B为0.25%四甲基氢氧化按溶液(用磷酸调节pH值至5.5)-乙腈-甲醇(500:300:200),每1000mL中加入0.1mol/L乙二胺四醋酸二钠溶液0.4mL,按表1进行线性梯度洗脱,柱温为40℃,检测波长为254nm,进样体积20μL。
表1 梯度洗脱程序
时间(分钟)
流动相A(%)
流动相B(%)
0
95
5
2
95
5
22
75
25
32
50
50
37
50
50
38
95
5
48
95
5
系统适用性要求:系统适用性溶液色谱图中,头孢地尼的保留时间约为22分钟,头孢地尼峰与杂质J峰之间的分离度应不小于1.2,杂质I峰与杂质J峰之间、头抱地尼峰与杂质K峰之间及杂质K峰与杂质L峰之间的分离度均应符合 要求。灵敏度溶液色谱图中,主成分峰高的信噪比应大于10。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度:供试品溶液色谱图中如有杂质峰,杂质峰面积与对照溶液主峰面积比较,均应不得过表2中的限度值,各杂质峰面积的和不得大于对照溶液主峰面积的3倍(3.0%),小于灵敏度溶液主峰面积的峰忽略不计。
水分
取本品,加甲酰胺与甲醇的混合溶液(2:1)使溶解,照水分测定法(通则0832第一法1)测定,含水分不得过2.0%。
表2 头孢地尼特定杂质的相对保留时间及限度
杂质名称
相对保留时间
限度(%)
杂质A
0.14
0.5
杂质B
0.29
0.2
杂质C
0.37
0.2
杂质D
0.45
0.2
杂质E
0.57
0.5
杂质F
0.71
0.5
杂质G
0.74
0.7
杂质H
0.74
0.7
杂质I
0.86
0.7
杂质J
0.95
0.7
杂质K
1.10
0.7
杂质L
1.14
0.7
杂质M
1.19
0.7
杂质N
1.19
0.7
杂质O
1.31
0.2
杂质P
1.51
0.5
杂质Q
1.59
0.5
杂质R
1.65
0.5
杂质S
1.70
0.5
杂质T
1.75
0.5
杂质U
1.83
0.5
单个未知杂质
0.2
注:表中限度0.2%、0.5%、0.7%,即为杂质的峰面积不得大于对照溶液主峰面积的0.2倍、0.5倍、0.7倍,其中杂质G与杂质H峰面积之和不得大于对照溶液主峰面积的0.7倍,杂质I、杂质J 、杂质K与杂质L峰面积之和不得大于对照溶液主峰面积的0.7倍,杂质M与杂质N峰面积之和不得大于对照溶液主峰面积的0.7倍。
炽灼残渣
取本品1.0g,依法检查(通则0841),遗留残渣不得过0.2%。
重金属
取炽灼残渣项下遗留的残渣,依法检查(通则9821第二法),含重金属不得过百万分之十。
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品约20mg,精密称定,置100mL棕色量瓶中,加上述0.1mol/L磷酸盐缓冲液2mL溶解后,用流动相稀释至刻度,摇匀。
对照品溶液
取头孢地尼对照品约20mg,精密称定,置100mL棕色量瓶中,加上述0.1mol/L磷酸盐缓冲液2mL溶解后,用流动相稀释至刻度,摇匀。
系统适用性溶液
取头孢地尼对照品约20mg,置100mL棕色量瓶中,加上述0.1mol/L磷酸盐缓冲液2mL溶解后,用流动相稀释至刻度,摇匀,在水浴中加热约35分钟,放冷,得每1mL中约含0.2mg头抱地尼与其降解杂质的混合溶液(其中相对主峰保留时间0.9与1.2处杂质的量各约为2%)。
色谱条件
用十八烷基硅烷键合硅胶为填充剂,以0.25%四甲基氢氧化按溶液(用磷酸调节pH值至5.5)-乙腈-甲醇(900:60:40),每1000mL中加入0.1mol/L乙二胺四醋酸二钠溶液0.4mL为流动相,检测波长为 254nm, 进样体积20μL。
系统适用性要求
系统适用性溶液色谱图中,头抱地尼峰保留时间约为8分钟,E-异构体的保留时间约为头孢地尼峰保留时间的3.5倍,头孢地尼峰与其相对保留时间0.9和1.2处杂质峰之间的分离度均应不小于1.2。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
类别
β-内酰胺类抗生素,头抱菌素类。
贮藏
遮光,密封,在阴凉处保存。
制剂
头孢地尼胶囊。
药品简介
适应症
对头孢地尼敏感的葡萄球菌属、链球菌属、肺炎球菌、消化链球菌、丙酸杆菌、淋病奈瑟氏菌、卡他莫拉菌、大肠埃希菌、克雷伯菌属、奇异变形杆菌、普鲁威登斯菌属、流感嗜血杆菌等菌株所引起的下列感染:
1、咽喉炎、扁桃体炎、急性支气管炎、肺炎;
2、中耳炎、鼻窦炎;
3、肾盂肾炎、膀胱炎、淋菌性尿道炎;
4、附件炎、宫内感染、前庭大腺炎;
5、乳腺炎、肛门周围脓肿、外伤或手术伤口的继发感染;
6、毛囊炎、疖、疖肿、痈、传染性脓疱病、丹毒、蜂窝组织炎、淋巴管炎、甲沟炎、皮下脓肿、粉瘤感染、慢性脓皮症;
7、眼睑炎、麦粒肿、睑板腺炎。
用法用量
用水分散后口服或直接吞服。
成人服用的常规剂量为一次100mg,一日三次。
儿童服用的常规剂量为每日9-18mg/kg,分三次口服。
剂量可以年龄、症状进行适量增减,或遵医嘱。
不良反应
据国外临床试验数据,在使用本品治疗的13,715名患者中,有354例(2.58%)不良反应(包括实验室数据异常)的报告。主要不良反应为消化道症状(110例,0.80%),如腹泻或腹痛;皮肤症状(31例,0.23%),如皮疹或瘙痒。主要的实验室数据异常包括谷丙转氨酶(126例,0.92%)和谷草转氨酶(89例,0.65%)升高;嗜酸性粒细胞增多(41例,0.30%)。
临床不良反应
临床不良反应参照图
注:若出现上述症状,应立即停药并进行适当处理。
其他不良反应
1、皮肤科:可能发生史-约综合征(<0.1%)或毒性表皮坏死松解症(<0.1%)。应严密观察患者,若出现发热、头痛、关节痛、皮肤或粘膜出现红斑/水泡、皮肤感觉紧绷/灼烧/疼痛,应立即停药并进行适当处理。
2、过敏反应:可能发生过敏反应,如呼吸困难、红斑、血管性水肿、荨麻疹,发生率<0.1%。应严密观察患者,若出现异常情况,应立即停药并进行适当处理。
3、休克:可能发生休克,发生率<0.1%。应严密观察患者,若出现感觉不适感、口内不适感、喘憋、眩晕、便意、耳鸣或出汗等症状,应立即停药并进行适当处理。
4、血液学:可能发生全血细胞减少症(<0.1%)、粒细胞缺乏症(<0.1%,初期症状为发热、咽喉痛、头痛、不适)、血小板减少症(<0.1%,初期症状为瘀斑、紫癜)或溶血性贫血(<0.1%,初期症状为发热、血红蛋白尿、贫血症状)。应严密观察患者,若出现异常情况,应立即停药并进行适当处理。
5、结肠炎:可能发生严重的结肠炎(<0.1%),如经血便证实的伪膜性结肠炎。应严密观察患者,若出现腹痛或频繁腹泻等症状,应立即停药并进行适当处理。
6、间质性肺炎或PIE综合征:可能发生经发热、咳嗽、呼吸困难、胸部X光检查异常或嗜酸粒细胞增多证实的间质性肺炎或PIE综合征(<0.1%)。若出现此类症状,应立即停药并进行适当处理,如使用肾上腺皮质激素类药物。
7、肾脏疾病:可能发生严重肾脏疾病(<0.1%),如急性肾衰竭。应严密观察患者,若出现异常情况,应立即停药并进行适当处理。
8、暴发性肝炎、肝功能异常或黄疸:可能发生严重肝炎(<0.1%),如伴有明显谷丙转氨酶、谷草转氨酶或碱性磷酸酶升高的暴发性肝炎、肝功能异常(<0.1%)或黄疸(<0.1%)。应严密观察患者,若出现异常情况,应立即停药并进行适当处理。
禁忌
对本品有休克史者禁用,对青霉素或头孢菌素有过敏史者慎用。
注意事项
据惯例,应在确定微生物对本品的敏感性后,本品的疗程应限于治疗患者所需的最短周期,以防止耐药菌的产生。
建议避免与铁制剂合用。如果合用不能避免,应在服用本品3小时以后再使用铁制剂。
因有出现休克等过敏反应的可能,应详细询问过敏史。
下列患者应慎重使用
1、对青霉素类抗生素有过敏史者;
2、本人或亲属中有易发生支气管哮喘、皮疹、荨麻疹等过敏症状体质者;
3、严重的肾功能障碍者:由于头孢地尼在严重肾功能障碍患者血清中存在时间较长,应根据肾功能障碍的严重程度酌减剂量以及延长给药间隔时间。对于进行血液透析的患者,建议剂量一日1次,一次100mg;
4、患有严重基础疾病、不能很好进食或非经口摄取营养者、高龄者、恶液质等患者(因可出现维生素K缺乏,要进行严密临床观察)。
对临床检验值的影响
1、除试纸法尿糖试验之外,在用Benedict试剂、Fehling试剂和Clinitest试验法进行尿糖检查时,可出现假阳性,要注意。
2、可出现直接血清抗球蛋白试验阳性,要注意。
其他注意事项
1、与添加铁的产品(如奶粉或肠营养剂)合用时,可能出现红色粪便。
2、可能出现红色尿。
孕妇及哺乳期妇女用药
有关妊娠期的用药,其安全性尚未确立。对孕妇或怀疑有妊娠的妇女,用药要权衡利弊,只有在利大于弊的情况下,才能使用。
哺乳期妇女用药应权衡利弊,只有在利大于弊的情况下,才能使用。
儿童用药
对于体重过低的早产儿、新生儿的用药安全性尚未确立。
老年用药
老年患者使用本品时应特别注意以下方面,并根据对患者的临床观察调整剂量和给药间隔:
1、由于身体机能下降,老年患者可能容易出现不良反应。
2、由于维生素K缺乏,老年患者可能会有出血倾向。
药物相互作用
本品与下列药物合用时需慎重。
药物相互作用
药物过量
超剂量使用头孢地尼没有进行研究。在急性、毒性、侵蚀性溃疡的研究中,单一口服5600mg/kg剂量并未产生副作用。而其他β-内酰胺类抗生素,超剂量用药时可表现为以下副作用:恶心、呕吐、腹泻和惊厥。血清透析可以清除人体内的头孢地尼。对超剂量用药引起毒性反应的患者,血液透析是有用的,尤其是肾功能不全患者。
药理毒理
抗菌作用
对革兰阳性菌和革兰阴性菌有广范围的抗菌谱,特别是对革兰阳性菌中的葡萄球菌属、链球菌属等,比以往的口服头孢菌素有更强的抗菌活性,其作用方式是杀菌性的。对多种细菌产生的β-内酰胺酶稳定,对β-内酰胺酶的产生菌也具有优异的抗菌活性。
作用机制
作用机制为阻止细菌细胞壁的合成,对青霉素结合蛋白(PBP)1(1a,1bs)、2、3的亲和力强,但对不同细菌的活性部位有所差异。
毒理研究
在大鼠和犬等试验动物中对头孢地尼进行的急性和慢性毒性研究表明,头孢地尼可被很好耐受。未发现头孢地尼有致畸性和致突变性。
药代动力学
血药浓度
6名健康成人一次空腹口服50、100、200mg(效价)头孢地尼时,约经4小时后可达到血药峰浓度,分别为0.64、1.11和1.74μg/mL,其血浆半衰期为1.6~1.8小时。
男性健康成人单次口服头孢地尼后的血浆药物浓度曲线
6名健康成人一次空腹和进食后口服100mg(效价)头孢地尼,约经4小时后,可达到血药峰浓度,分别为1.25、0.79μg/mL。进食后给药,其吸收稍有降低。
肾功能受损患者一次口服100mg(效价)头孢地尼,血浆半衰期延长与肾受损程度成正比。
肾功能受损患者单次口服头孢地尼的血浆半衰期
6名血液透析患者餐后一次口服100mg(效价)后,本品血浆半衰期延长近11倍。在相同的患者中餐后一次口服100mg(效价)头孢地尼,在血药浓度达峰值时血液透析4小时。进行血液透析者的半衰期缩短,约为不进行血液透析者的1/6,清除率为61%。
6名血液透析患者单次口服头孢地尼的血浆半衰期
分布:在患者痰液、扁桃体、上颌窦粘膜组织、中耳分泌物、皮肤组织和口腔组织等均有分布,尚不知是否在乳汁中有分布。
代谢:人体血液、尿及粪便中未发现有抗菌活性的代谢产物。
排泄:头孢地尼主要经肾脏排泄。
健康成人(空腹)口服50、100、200mg(效价)时,尿排泄率(0~24小时)约为26%~33%,4~6小时的尿液峰值浓度分别为44.3、81.5和132μg/mL。
肾功能受损患者一次口服100mg(效价)头孢地尼,排泄缓慢,并与肾受损程度成正比。
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。