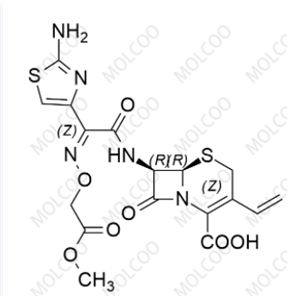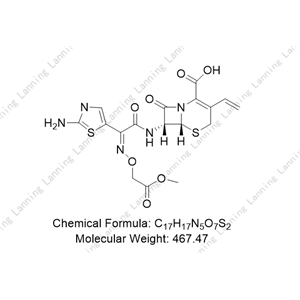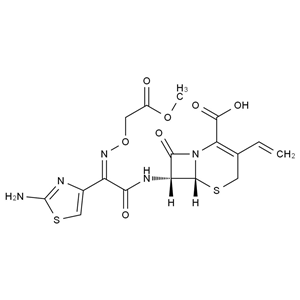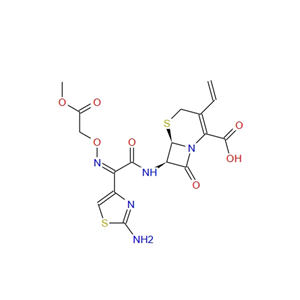

化合物简介
基本信息
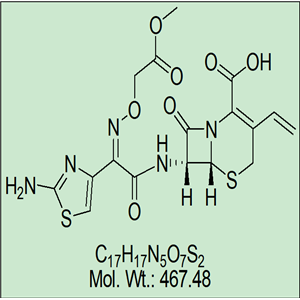
化学式:C16H15N5O7S2
分子量:453.450
CAS号:79350-37-1
理化性质
密度:1.85g/cm3
熔点:218-225℃
外观:白色至灰白色结晶性粉末
分子结构数据
摩尔折射率:130.08
摩尔体积(cm3/mol):302.7
等张比容(90.2K):898.9
表面张力(dyne/cm):77.7
极化率(10-24cm3):51.57
药品简介
适应症
头孢克肟用于治疗敏感菌所致的下列感染:
1.呼吸系统感染,如支气管炎、肺炎等;
2.泌尿系统感染,如肾盂肾炎、膀胱炎、尿道炎等;
3.胆道感染,如胆囊炎、胆管炎;
4.其他,如中耳炎、鼻窦炎、猩红热等。
临床应用
头孢克肟为口服给药。
肾功能不全患者需要调整剂量,肌酐清除率≥60mL/min时按照普通用量和给药间隔使用;肌酐清除率在21~60mL/min之间,按照正常给药间隔给予正常剂量75%;肌酐清除率小于20mL/min,按照正常给药间隔给予正常剂量的50%。
不良反应
头孢克肟的不良反应多数短暂而轻微。
1、过敏反应:常见皮疹、荨麻疹、红斑,少见瘙痒、发热、水肿、呼吸困难、全身潮红、血管神经性水肿及过敏性休克。
2、胃肠道反应:常见腹泻、胃部不适,少见胸部烧灼感、食欲缺乏、恶心、呕吐、腹痛、腹胀、便秘及菌群失调所致口腔炎、口腔念珠菌症、假膜性肠炎等。
3、呼吸系统:少见伴有发热、咳嗽、呼吸困难、胸部X线异常、嗜酸粒细胞增多的间质性肺炎和肺嗜酸粒细胞浸润症(PIE综合征)。
4、血液系统:常见嗜酸粒细胞增多,少见粒细胞减少、溶血性贫血、血小板减少。
5、肝脏:常见丙氨酸氨基转移酶、天门冬氨酸氨基转移酶及碱性磷酸酶升高,少见黄疸。
6、肾脏:少见尿素氮和急性肾功能不全。
7、其他:少见头痛、头晕、Stevens-Johnson综合征、中毒性表皮坏死松解症(Lyell综合征)和维生素K、B缺乏。
注意事项
1、孕妇及哺乳期妇女、6个月以下儿童使用头孢克肟的安全性和有效性尚未确立。孕妇需权衡利弊后使用。美国食品药品监督管理局(FDA)对头孢克肟的妊娠安全性分级为B级。哺乳期妇女使用头孢克肟时应暂停哺乳。
2、下列患者须慎用:
①有青霉素过敏史的患者;
②本人及直系亲属有过敏体质者;
③肾功能不全患者;
④经口给药困难或非经口摄取营养患者,全身恶液质状态患者(因可能出现维生素K);
⑤假膜性肠炎患者。
3、治疗化脓性链球菌感染疗程至少需10天。
4、所用剂量相同时,口服混悬剂较口服片剂的血药浓度高25%~50%。中耳炎患者宜用混悬剂治疗。
用药禁忌
对头孢菌素类抗生素有过敏史者禁用。
药物相互作用
1、与其他头孢菌素、强利尿药(如呋塞米、依他尼酸、布美他尼等)、多粘菌素类、氨基糖苷类抗生素及万古霉素合用时,有增加肾毒性的可能。
2、与丙磺舒、阿司匹林、卡马西平合用,可升高头孢克肟血药浓度;必要时需要监测卡马西平血药浓度。
3、与香豆素类药物合用,可能增强香豆素类药物的作用。机制可能为肠道菌群失调造成维生素K合成抑制。
4、与华法林合用,可延长凝血酶原时间。
5、与氯霉素合用,可能产生相互拮抗作用。
6、与多种药物存在药物相互作用,如果同时服用其他药物,请咨询医师或药师。
7、棒酸可增加本品对某些因产生β-内酰胺酶而对之耐药的革兰阴性杆菌的抗菌活性。
说明:上述内容仅作为介绍,药物使用必须经正规医院在医生指导下进行。
药典信息
基本信息
本品为(6R,7R)-7-[[(Z)-2-(2-氨基-4-噻唑基)-2-[(羧甲氧基)亚氨基]乙酰基]氨基]-3-乙烯基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸三水合物,按无水物计算,含头孢克肟(按C16H15N5O7S2计)不得少于95.0%。
性状
本品为白色至淡黄色结晶性粉末,无臭或略有特殊臭味。
本品在甲醇中溶解,在乙醇中微溶,在水或乙醚中不溶。
比旋度
取本品,精密称定,用2%碳酸氢钠溶液溶解并定量稀释制成每1mL中约含10mg的溶液,依法测定(通则0621),比旋度应为-75°至-88°。
鉴别
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2、本品的红外光吸收图谱应与对照品的图谱一致。如不一致,可分别取本品和对照品适量,加甲醇溶解,挥干溶剂后,取残留物照红外分光光度法(通则0402)测定,二者的红外光吸收图谱应一致。
检查
酸度
取本品,加水制成每1mL中含0.7mg混悬液,依法测定(通则0631),pH值应为2.6~4.1。
有关物质
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品适量,加磷酸盐缓冲液(pH7.0)溶解并稀释制成每1mL中约含1mg的溶液。
对照溶液:精密量取供试品溶液适量,用磷酸盐缓冲(pH7.0)定量稀释制成每1mL中约含0.01mg的溶液。
系统适用性溶液:取头孢克肟对照品适量,加水溶解并稀释制成每1mL中约含1mg的溶液,于沸水浴上加热45分钟,冷却。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以四丁基氢氧化铵溶液(取10%四丁基氢氧化铵溶液25mL,加水1000mL,摇匀,用1.5mol/L磷酸溶液调节pH值至7.0)-乙腈(72:28)为流动相,检测波长为254nm,柱温为40°C,进样体积20µL。
系统适用性要求:系统适用性溶液色谱图中,按头孢克肟(E)异构体、头孢克肟的顺序出峰,头孢克肟(E)异构体峰与头孢克肟峰之间的分离度应符合要求。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍。
限度:供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的3倍(3.0%),小于对照溶液主峰面积0.1倍的峰忽略不计。
残留溶剂
照残留溶剂测定法(通则0861)测定。
内标溶液:取正丙醇适量,用N,N-二甲基甲酰胺稀释成每1mL中约含0.2mg的溶液。
供试品溶液:取本品约0.2g,精密称定,置顶空瓶中,精密加入内标溶液1.0mL使溶解,密封。
对照品溶液:取各溶剂对照品适量,精密称定,用内标溶液定量稀释制成每1mL中含甲醇600µg、乙醇1mg、乙酸1mg、丙酮1mg、异丙醇1mg、二氯甲烷120µg、异丙醚1mg、四氢呋喃150µg、乙酸乙酯1mg、乙酸异丙酯1mg、吡啶40µg、苯甲醚1mg的混合对照品溶液。精密量取混合对照品溶液1mL,置顶空瓶中,密封。
系统适用性溶液:分别取乙醇和乙醚各适量,用内标溶液定量稀释制成每1mL中约含乙醇和乙醚各1mg的溶液,精密量取1.0mL,置顶空瓶中,密封。
色谱条件:以6%氰丙基苯基-94%二甲基聚硅氧烷为固定液(或极性相近)的毛细管柱为色谱柱,起始温度为40℃维持22分钟,再以每分钟100℃的速率升温至120℃,维待10分钟,进样口温度为200℃,检测器温度为250℃,顶空瓶平衡温度为70℃,平衡时间为30分钟。
系统适用性要求:系统适用性溶液色谱图中,按乙醇、乙醚和正丙醇(内标)的顺序出峰,各峰间的分离度均应符合要求。
测定法:首先顶空进样甲烷气体,记录甲烷的保留时间作为色谱系统的死时间(t0),再顶空进样供试品溶液,记录色谱图,色谱图中如有色谱峰,按下式计算供试品溶液色谱图中各色谱峰的保留时间(tR)相对于正丙醇保留时间[tR(正丙醇)]的相对调整保留时间(RART):
将得到的RART值与下表的RART值比较,确定供试品中的残留溶剂种类,再制备相应的对照品溶液,顶空进样对照品溶液,记录色谱图。
溶剂
RART值
甲醇
0.182
乙醇
0.363
乙醚
0.393
丙酮
0.482
异丙醇
0.529
二氯丙烷
0.649
异丙醚
0.968
正丙醇
1.000
乙酸乙酯
1.343
四氢呋喃
1.454
乙酸异丙酯
2.014
吡啶
3.023
苯甲醚
5.093
限度:按内标法以峰面积比值计算供试品中各残留溶剂的含量,异丙酪和苯甲酪的残留最均不得过0.5%, 甲醇、乙醇、乙酪、丙酮、异丙醇、二氯甲烧、乙酸乙酉自四氢吠喃、乙酸异丙酣与Plt唗的残留羁均应符合规定。
水分
取本品,照水分测定法(通则0832第一法1)测定,含水分应为9.0%~12.0%。
炽灼残渣
取本品1.0g,依法检查(通则0841),遗留残渣不得过0.2%。
重金属
取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品,精密称定,加流动相溶解并定量稀释制成每1mL中约含头孢克肟(按C16H15N5O7S2计)0.2mg的溶液。
对照品溶液
取头孢克肟对照品适量,精密称定,加流动相溶解并定量稀释制成每1mL中约含头孢克肟(按C16H15N5O7S2计)0.2mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求
见有关物质项下。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算供试品中C16H15N5O7S2的含量。
类别
β-内酰胺类抗生素,头孢菌素类。
贮藏
遮光,密封,在阴凉处保存。
制剂
1、头孢克肟片。
2、头孢克肟胶囊。
3、头孢克肟颗粒。
安全信息
安全术语
S22:Do not breathe dust.
不要吸入粉尘。
S36/37:Wear suitable protective clothing and gloves.
穿戴适当的防护服和手套。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the lable where possible).
发生事故时或感觉不适时,立即求医(可能时出示标签)。
风险术语
R42/43:May cause sensitization by inhalation and skin contact.
吸入和皮肤接触可能引起过敏。
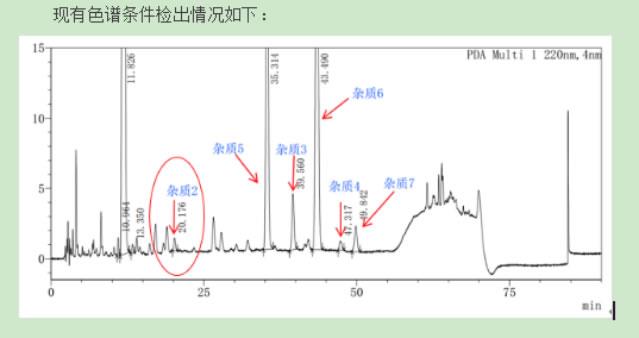
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。