桐晖药业 -提供原料药、参比制剂、杂质对照品、进口药品注册代理、致力于为客户提供一站式整体解决方案,欢迎来电咨询!
中文名称:克拉维酸钾EP杂质C
英文名:Clavulanate Potassium EP Impurity C
CAS号:86917-74-0
产品编码:REF-C64003
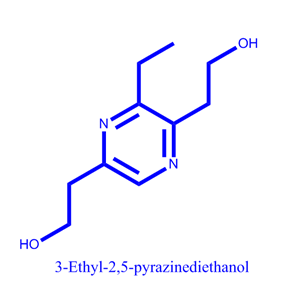
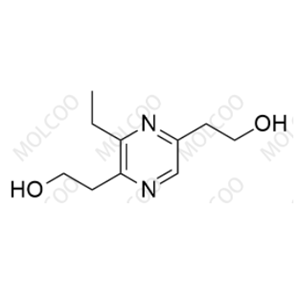
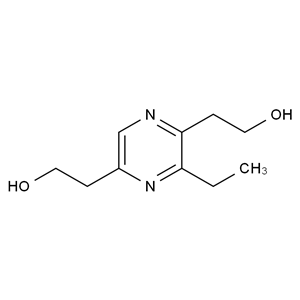
分子式:C10H16N2O2
分子量:196.25
纯度:97.02%
产品性质:客户定制
外观性状:黄色油状
储存条件:-20℃
化学名称:2,2'-(3-ethylpyrazine-2,5-diyl)bis(ethan-1-ol)
克拉维酸钾EP杂质C,克拉维酸钾EP杂质C标准品,克拉维酸钾EP杂质C对照品


化合物简介
计算化学数据
疏水参数计算参考值(XlogP):无
氢键供体数量:1
氢键受体数量:5
可旋转化学键数量:2
互变异构体数量:2
拓扑分子极性表面积:89.9
重原子数量:15
表面电荷:0
复杂度:329
同位素原子数量:0
确定原子立构中心数量:2
不确定原子立构中心数量:0
确定化学键立构中心数量:1
不确定化学键立构中心数量:0
共价键单元数量:2
药品简介
适应症
单独应用无效。常与青霉素类药物联合应用以克服微生物产β-内酰胺酶而引起的耐药性,提高疗效。
用法用量
内服:一次10-15mg/kg(以阿莫西林计),一日2次。
皮下、肌内注射:一次6-7mg/kg(以阿莫西林计),一日1次。
药代动力学
口服125mg,1~2小时内平均血清峰药浓度为2.3μg/mL,在6小时内,血清AUC为5μg/mL/小时,t1/2约为1小时。本品在体内分布较广,可渗入许多体液中,但在脑组织和脑脊液中浓度甚微。在6小时内,有25%~40%药物,以原形由尿排泄。
药理作用
仅有微弱的抗菌活性,但可与多数的β-内酰胺酶牢固结合,生成不可逆的结合物、它具有强力而广谱的抑制β-内酰胺酶的作用,不仅对葡萄球菌的酶有作用,而且对多种革兰阴性菌所产生的酶也有作用,因此为一有效的β-内酰胺酶抑制药。
药典信息
基本信息
本品为(Z)-(2S,5R)-3-(2-羟亚乙基)-7-氧代-4-氧杂-1-氮杂双环[3.2.0]庚烷-2-羧酸钾,按无水物计算,含克拉维酸(C8H9NO5)应为81.0%~85.6%。
性状
本品为白色至微黄色结晶性粉末,微臭,极易引湿。
本品在水中极易溶解,在甲醇中易溶,在乙醇中微溶,在乙醚中不溶。
比旋度
取本品,精密称定,加水溶解并定量稀释制成每1mL中约含10mg的溶液,依法测定(通则0621),比旋度为+55°至+60°。
鉴别
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2、本品的红外光吸收图谱应与对照的图谱(光谱集950图)一致。
3、本品的水溶液显钾盐鉴别2的反应(通则0301)。
检查
酸碱度
取本品0.20g,加水20mL溶解后,依法测定(通则0631),pH值应为6.0~8.0。
吸光度
取本品50mg,精密称定,置50mL量瓶中,加pH7.0的0.1mol/L磷酸盐缓冲液(称取磷酸二氢钾1.361g,置100mL量瓶中,加水溶解并稀释至刻度,用35%氢氧化钠溶液调节pH值至7.0)溶解并稀释至刻度,摇匀,照紫外-可见分光光度法(通则0401),在278nm的波长处立即测定,吸光度不得过0.40。
有关物质
照高效液相色谱法(通则0512)测定,临用新制。
供试品溶液:取本品适量,加流动相A溶解并稀释制成每1mL中含克拉维酸约8mg的溶液。
对照溶液:精密量取供试品溶液适量,用流动相A定量稀释制成每1mL中约含克拉维酸0.08mg的溶液。
系统适用性溶液:取阿莫西林与克拉维酸对照品各适量,加流动相A溶解并稀释制成每1mL中各约含2mg的混合溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以0.05mol/L磷酸二氢钠溶液(用磷酸调节pH值至4.0)为流动相 A,以0.05mol/L磷酸二氢钠溶液(用磷酸调节pH值至4.0)-甲醇(50:50)为流动相B,按下表进行线性梯度洗脱,柱温为40数二十度,检测波长为230nm,进样体积20μL。
时间(分钟)
流动相A(%)
流动相B(%)
0
100
0
4
100
0
15
50
50
18
50
50
24
100
0
39
100
0
系统适用性要求:系统适用性溶液色谱图中,克拉维酸峰与阿莫西林峰的相对保留时间分别为1.0与2.5,克拉维酸峰与阿莫西林峰间的分离度应大于13。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度:供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积(1.0%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(2.0%),小于对照溶液主峰面积0.05倍的峰忽略不计。
残留溶剂
照残留溶剂测定法(通则0861第二法)测定。
供试品溶液:取本品约0.2g,精密称定,置顶空瓶中,精密加入氯化钠0.5g,精密加1mol/L氢氧化钠溶液2mL,密封。
对照品溶液:分别取丙酮、异丙醇、甲苯与正丁醇各适量,精密称定,用1mol/L氢氧化钠溶液定量稀释制成各自的贮备液,分别精密量取适量,用1mol/L氢氧化钠溶液定量稀释制成每1mL中分别约含丙酮0.5mg、异丙醇0.5mg、甲苯0.089mg和正丁醇0.5mg的混合溶液,精密量取2mL,置顶空瓶中,精密加入氯化钠0.5g,密封。
色谱条件:以硝基对苯二酸改性的聚乙二醇(或极性相近)为固定液的毛细管柱为色谱柱,起始温度60°C,维持10分钟,再以每分钟20°C的速率升温至120℃,维持8分钟,进样口温度为150℃,检测器温度为250℃,顶空瓶平衡温度为80℃,平衡时间为30分钟。
系统适用性要求:对照品溶液色谱图中,丙酮、异丙醇、甲苯和正丁醇依次出峰,各主峰间的分离度均应符合要求。
测定法:取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度:按外标法以峰面积计算,丙酮、异丙醇、甲苯与正丁醇的残留量均应符合规定。
2-乙基己酸
取本品,依法测定(通则0873),不得过0.8%。
水分
取本品,照水分测定法(通则0832第一法1)测定,含水分不得过0.5%。
重金属
取本品0.2g,加水23mL溶解后,加醋酸盐缓冲液(pH3.5)2rnL,依法检查(通则0821第一法),含重金属不得过百万分之二十。
可见异物
取本品5份,每份各0.2g,加微粒检查用水溶解,依法检查(通则0904),应符合规定。(供无菌分装用)
不溶性微粒
取本品,加微粒检查用水制成每1mL中含60mg的溶液,依法检查(通则0903), 每1g样品中含10μm及10μm以上的微粒不得过6000粒,含25μm及25μm以上的微粒不得过600粒。(供无菌分装用)
细菌内毒素
取本品,依法检查(通则1143),每1mg克拉维酸中含内毒素的量应小于0.030EU。(供注射用)
无菌
取本品,用适宜溶剂溶解并稀释后,经薄膜过滤法处理,依法检查(通则1101),应符合规定。(供无菌分装用)
含量测定
照高效液相色谱法(通则0512)测定,临用新制。
供试品溶液
取本品适量(约相当于克拉维酸25mg),精密称定,置100mL量瓶中,加水溶解并稀释至刻度,摇匀。
对照品溶液
取克拉维酸对照品适量,精密称定,加水溶解并定量稀释制成每1mL中约含克拉维酸0.25mg的溶液。
系统适用性溶液
取克拉维酸对照品与阿莫西林对照品各适量,加水溶解并稀释制成每1mL中约含克拉维酸0.25mg与阿莫西林(按 C16H19N3O5S计)0.45mg的混合溶液。
色谱条件
用十八烷基硅烷键合硅胶为填充剂,以磷酸盐缓冲液(取磷酸二氢钠7.5g,加水约900mL溶解,用稀磷酸或10mol/L氢氧化钠溶液调节pH值至4.4,用水稀释至1000mL-乙腈(95:5)为流动相,检测波长为220nm,进样体积20μL。
系统适用性要求
系统适用性溶液色谱图中,克拉维酸峰与阿莫西林峰间的分离度应大于3.5。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算供试品中C8H9NO5的含量。
类别
β-内酰胺酶抑制药。
贮藏
严封,在-20℃以下干燥处保存。
制剂
1、阿莫西林克拉维酸钾干混悬剂。
2、阿莫西林克拉维酸钾片。
3、阿莫西林克拉维酸钾分散片。
4、阿莫西林克拉维酸钾颗粒。
5、注射用阿莫西林钠克拉维酸钾。
安全信息
安全术语
S8:Keep container dry.
保持容器干燥。
S16:Keep away from sources of ignition - No smoking.
远离火源,禁止吸烟。
S22:Do not breathe dust.
不要吸入粉尘。
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
眼睛接触后,立即用大量水冲洗并征求医生意见。
S36/37:Wear suitable protective clothing and gloves.
穿戴适当的防护服和手套。
S43:In case of fire, use ... (if water increases the risk, add - never use water).
着火时使用(指明具体的消防器材种类,如果用水增加危险,注明“禁止用水”。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the lable where possible).
发生事故时或感觉不适时,立即求医(可能时出示标签)。
风险术语
R11:Highly flammable.
高度易燃的。
R14:Reacts violently with water.
与水猛烈反应。
R36:Irritating to eyes.
刺激眼睛。
R42/43:May cause sensitization by inhalation and skin contact.
吸入和皮肤接触可能引起过敏。
R44:Risk of explosion if heated under confinement.
在封闭情况下加热有爆炸危险。
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题。
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。