简介
【药物名称】舒巴坦钠Sulbactam Sodium
【药物别名】舒巴克坦钠、陪他美 Penicillanic Acid Sulfone
舒巴坦钠
【英文名称】Sulbactam
【说 明】1氨苄西林钠/舒巴坦钠注射液⑴ 0.75g(含舒巴坦钠0.25g+氨苄西林钠0.5g) ⑵1.50g(含舒巴坦钠0.50g+氨苄西林钠1.0g)</P><P>
2头孢哌酮钠/舒巴坦钠注射液⑴1.0g(含舒巴坦钠0.5g+头孢哌酮钠0.5g) ⑵2.0g(含舒巴坦钠1.0g+头孢哌酮钠1.0g)
成分
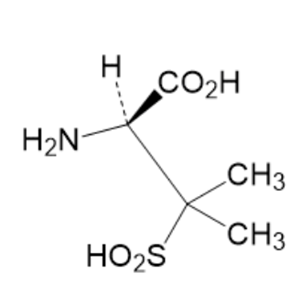
化学名:(2S,5R)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3,2,0]庚烷-2-羧酸钠-4,4-二氧化物。
舒巴坦钠结构式
分子式:C8H10NNaO5S。分子量:255.22。结构式:
性状:舒巴坦钠为白色或类白色结晶性粉末;微有特臭,味微苦。在水中易溶,在甲醇中微溶,在乙醇中极微溶解,在丙酮或醋酸乙酯中几乎不溶。
舒巴坦为不可逆性竞争型β-内酰胺酶抑制剂,由合成法制取。该品为舒巴坦钠盐,按无水物计算,含舒巴坦(C8H11NO5S)应不得少于88.6%。
合成路线
合成线路共1页
68373-14-8
舒巴坦酸
~92%
69388-84-7
舒巴坦钠
文献: : SANDOZ AG Patent: WO2009/53256 A2, 2009 ; Location in patent: Example 1 ;
762-04-9
亚磷酸二乙酯
76646-91-8
(2S,5R)-6,6-dib...
~77%
69388-84-7
舒巴坦钠
文献: : Leo Pharmaceutical Products Ltd. A/S Patent: US4816580 A1, 1989 ;
合成路线
制剂规格
氨苄西林钠/舒巴坦钠注射液⑴ 0.75g(含舒巴坦钠0.25g+氨苄西林钠0.5g) ⑵1.50g(含舒巴坦钠0.50g+氨苄西林钠1.0g)
贮法:室温下,避光、密闭、防潮保存。
头孢哌酮钠/舒巴坦钠注射液⑴1.0g(含舒巴坦钠0.5g+头孢哌酮钠0.5g) ⑵2.0g(含舒巴坦钠1.0g+头孢哌酮钠1.0g)
药理毒理
该品为β内酰胺酶抑制剂,对β内酰胺酶有抑制作用,可使青霉素类及头孢菌素类药物免遭酶的破坏,大大加强了抗菌活力。对葡萄球菌、卡他球菌、奈瑟淋球菌、大肠杆菌、克雷白杆菌、嗜血杆菌及拟杆菌等的抗菌活性显著增强。
药动学
舒巴坦钠口服后吸收差。肌内注射0.5和1.0g,半小时后平均血药峰浓度分别为13和28μg/mL。30分钟静脉滴注舒巴坦钠0.5和1.0g,血药峰浓度分别为20和43μg/mL。半衰期为1小时。同时给予氨苄西林,舒巴坦血清浓度变化不大。
药物吸收后分布广泛,可渗入女性生殖器官、肠粘膜、腹腔液、组织间液等中,舒巴坦也可透过胎盘屏障,乳汁中亦可检出舒巴坦。细菌性脑膜炎患者静脉给舒巴坦钠1g和氨苄西林0.8-2g,1~4小时后脑脊液中舒巴坦为0.5-12μg/mL。该品主要经肾随尿液排出。注射给药后6小时,约70%的药物以原形经尿液排出,24小时尿中排出量为给药量的85%。
适应症
呼吸系统、泌尿系统、皮肤软组织、骨和关节部位感染和腹部感染以及败血症等治疗。单独应用对淋球菌和脑膜炎球菌的周围感染有效;舒巴坦与氨苄西林或头孢哌酮联合治疗敏感细菌所致的呼吸道、尿路、妇产科、腹腔内、皮肤软组织、眼耳鼻喉科和骨关节感染以及败血症、脑膜炎等。
禁忌症
⑴交叉过敏反应:舒巴坦/氨苄西林禁用于对青霉类抗生素过敏者。
⑵舒巴坦/氨苄西林可透过胎盘到达胎儿,母乳中亦含有该品,虽其在孕妇、乳妇的应用尚无问题发生的报告 ,但应用时仍须权衡利弊。
⑶肾功能减退病人应用该品时须适当减量;肾功能正常者每 6小时给药一次,舒巴坦和氨苄西林各 0.5g;肾小球滤过率为每分钟 15~30ml、5~14ml和< 5ml时,给药次数分别为每日2次、每日1次及隔日1次。
⑷单核细胞增多症患者应用该品时皮疹发生率较高,该品一般不用于此病患者。
不良反应
舒巴坦钠不良反应发生率较低(约10%以下),用药时需中止治疗者仅0.7%。主要不良反应有:
⒈恶心、呕吐、腹泻、腹痛等胃肠道症状。
⒉大剂量且长期用药偶见肝酶升高。
⒊大剂量且长期用药时罕见贫血、血小板减少、白细胞减少。
⒋用药时可出现注射区疼痛、硬结;给药速度过快可致血栓性静脉炎。
⒌此外尚有用药后致瘙痒、皮疹、头痛、头晕的报道。
另外,实验室检查异常者有转氨酶(AST9.3%,ALT8.9%)、碱性磷酸酶、乳酸脱氢酶升高等。可能引起过敏反应:皮疹,药热,面部潮红或苍白,气喘,心悸,胸闷,腹痛,过敏性休克.
相互作用
⒈舒巴坦钠与青霉素类和头孢菌素类抗生素合用时有协同抗菌作用。可使对青霉素类和头孢菌素类抗生素耐药的金黄色葡萄球菌、流感杆菌、大肠杆菌、脆弱类杆菌等的最小抑菌浓度(MIC)降到敏感范围之内。
⒉舒巴坦钠与氨基糖苷类抗生素合用时,有协同抗菌作用。
⒊丙磺舒可减少舒巴坦经肾的排泄,两者合用时可升高舒巴坦的血药浓度。
⒋别嘌醇与舒巴坦钠合用可使皮疹发生率增高。
【用法用量】目前国内生产的舒巴坦钠产品主要为供静脉或肌内注射用的氨苄西林钠/舒巴坦钠、头孢哌酮钠/舒巴坦钠联合制剂。以下以氨苄西林钠/舒巴坦钠为例说明其用法与用量。
·成人
·常规剂量(含最大量、极量)
·静脉滴注
⒈成人每日剂量(舒巴坦及氨苄西林联合剂量)为1.5-12g,分为每6小时或8小时给药1次,静脉滴注15-30分钟。对不太严重感染可每12小时给药一次。舒巴坦的每日剂量不能超过4g。病情严重者(如脑膜炎)可增加氨苄西林剂量,但不增加舒巴坦剂量。
⒉预防外科手术感染:在诱导麻醉时予以舒巴坦/氨苄西林联合制剂1.5-3g,必要时每6小时重复一次,至24小时为止。
·静脉注射
成人每日剂量(舒巴坦及氨苄西林联合剂量)为1.5-12g,分为每6小时或8小时给药1次。对不太严重感染可每12小时给药一次。舒巴坦的每日剂量不能超过4g。静脉注射时间至少3分钟。
·肌内注射
成人每日剂量(舒巴坦及氨苄西林联合剂量)为1.5-12g,分为每6小时或8小时给药1次。对不太严重感染可每12小时给药一次。舒巴坦的每日剂量不能超过4g。
·肾功能不全时剂量
肾功能减退病人应用该品时须适当减量。肾小球滤过率为每分钟15-30mL、5-14mL和小于5mL时,给药次数分别为每日2次、每日1次和隔日1次。
·儿童
·常规剂量(含最大量、极量)
·静脉滴注
静脉滴注15-30分钟。
·静脉注射
静脉注射时间至少3分钟。
·肌内注射
给药说明
⒈舒巴坦钠与氨基酸输液、血液制品、蛋白水解物属配伍禁忌。
⒉舒巴坦钠与氨基糖苷类抗生素属配伍禁忌,联用时,严禁将二者混合于同一溶器中。
⒊舒巴坦钠在糖类溶液中稳定性较差,溶液应现配现用。肌内注射溶液应在配制后1小时内用完。
⒋该品肌内注射给药时应作深部肌注,并配以0.5%利多卡因溶解以减少疼痛。
注意事项
注意:凡对青霉素过敏者禁用。
舒巴坦钠与青霉素类药有交叉过敏。对青霉类抗生素过敏者禁用。孕妇、哺乳期妇女应慎用。严重肝、肾功能障碍患者慎用。单核细胞增多症患者慎用。高钠血症患者慎用。
药物对检验值或诊断的影响:少数患者用药后可出现转氨酶、碱性磷酸酶、乳酸脱氢酶升高;血小板、白细胞减少等。用药前后及用药时应当检查或监测的项目:长期用药时应定期检查肝、肾功能和血象等。
该品为(2S,5R)-3,3-二甲基-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-羧酸钠-4,4-二氧
化物。按无水物计算,含舒巴坦钠(C8H11NO5S)应不得少于88.6%。
性状
该品为白色或类白色粉末或结晶性粉末;微有特臭;味微苦。
该品在水中易溶,在甲醇中微溶,在乙醇、丙酮或醋酸乙酯中几乎不溶。
比旋度 取该品,精密称定,加水溶解并制成每1ml中含10mg的溶液,依法测定(附录Ⅵ E),比
旋度为+223°至+237°。
鉴别
⑴含量测定项下记录的色谱图,供试品主峰的保留时间应与舒巴坦对照品峰的保留
时间一致。
⑵该品的红外光吸收图谱应与对照的图谱(光谱集509图)一致。
⑶该品显钠盐的鉴别反应(附录Ⅲ)。
检查
溶液的澄清度与颜色 取该品5份,各0.3g,分别加水5ml溶解,溶液应澄清无色;如显
浑浊,与1号浊度标准液(附录Ⅸ B)比较,均不得更浓;如显色,与黄色或黄绿色3号标准比色液(附录
Ⅸ A 第一法)比较,均不得更深。
水分 取该品,照水分测定法(附录Ⅷ M 第一法 A)测定,含水分不得过1.0%。
结晶性 取该品少许,依法检查(附录Ⅸ D),应符合规定。
重金属 取该品,依法检查(附录Ⅷ H 第一法),含重金属不得过百万分之二十。
热原 取该品,加灭菌注射用水制成每1ml中含20mg的溶液,依法检查(附录Ⅺ D),剂量按家兔
体重
每1kg注射1ml,应符合规定。
无菌 取该品,分别加入100ml0.9%无菌氯化钠溶液中使溶解,用薄膜过滤法处理后,依法检查
(附录Ⅺ H),应符合规定。
【含量测定】照高效液相色谱法(附录Ⅴ D))测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以0.005mol/L四丁基氢氧化铵
溶液(取40%四丁基氢氧化铵溶液6.6ml,加水稀释至1800ml,用1mol/L磷酸溶液调节pH值至5.0±
0.1,再加水稀释至2000ml,摇匀)-乙腈(1650:350)为流动相;流速为每分钟1ml;检测波长为
230nm,理论板数按舒巴坦峰计算,应不低于3500。拖尾因子不大于1.5,舒巴坦峰与其他杂质峰之间
的分离度应符合规定。
测定法 取该品约55mg,精密称定,置50ml量瓶中,加流动相溶解并稀释至刻度,摇匀,取10μl
注入液相色谱仪,记录色谱图;另取舒巴坦对照品适量,加流动相制成每1ml中含1mg的溶液,同法测
定,按外标法以峰面积计算供试品中C8H11NO5S的含量。
【类别】β内酰胺酶抑制药。
【贮藏】严封,在阴凉干燥处保存。
【制剂】⑴注射用头孢哌酮钠舒巴坦钠⑵注射用氨苄西林钠舒巴坦钠
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题
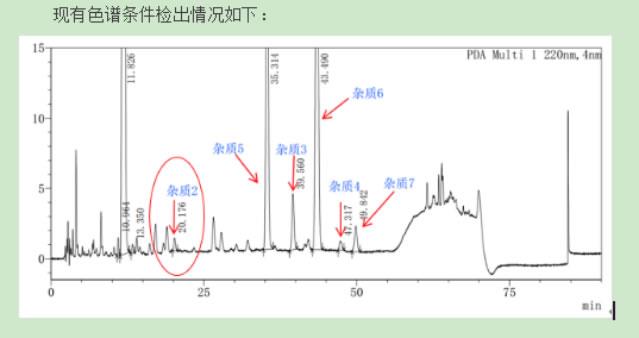
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。