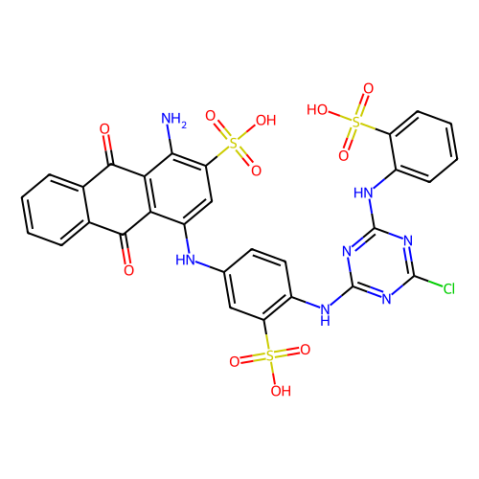
aladdin 阿拉丁 C377819 汽巴蓝琼脂糖(蓝胶) 84166-13-2
Cibacron Blue Agarose
84166-13-2
84166-13-2
¥1047.90
10ml
起订
¥245.90
1ml
起订
¥3699.90
50ml
起订
上海 更新日期:2025-05-16
产品详情:
- 中文名称:
- 汽巴蓝琼脂糖(蓝胶)
- 英文名称:
- Cibacron Blue Agarose
- CAS号:
- 84166-13-2
- 品牌:
- 阿拉丁
- 产地:
- 上海
- 保存条件:
- 2-8°C储存
- 产品类别:
- 化学和生化试剂 生化试剂
- 分子式:
- C29H17CIN7Na3O11S3
- 分子量:
- 840.1
- 运输条件:
- 冰袋运输
- 产品规格:
- 10ml、1ml、50ml
- 货号:
- C377819
- 是否进口:
- 否
公司简介
上海阿拉丁生化科技股份有限公司是A股上市公司((股票代码:688179),专注于科研试剂的研发、生产和销售,已陆续建立多个工厂和研发中心。作为领军企业,阿拉丁始终坚持质量第一,连续13年被评为“最受欢迎试剂品牌”。
阿拉丁目前常备库存试剂产品品种超过7万种,SKU总数超过46万,产品线涵盖了化学试剂、生化试剂、药靶配体、蛋白质和抗体等多个领域,是国内少数化学试剂到生物试剂全面发展的国产试剂品牌,产品同步发布在我们国内外电商平台。
| 成立日期 | (17年) |
| 注册资本 | 14130.676万人民币 |
| 员工人数 | 500人以上 |
| 年营业额 | ¥ 1亿以上 |
| 经营模式 | 工厂,试剂 |
| 主营行业 | 生物化工,化学试剂 |
汽巴蓝琼脂糖(蓝胶)相关厂家报价
-

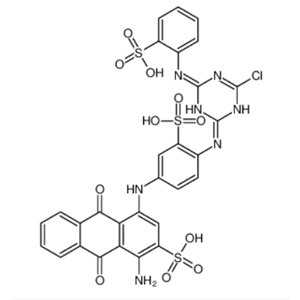
- 汽巴兰3GA
- 上海康朗生物科技有限公司 VIP
- 2026-02-09
- ¥4500
-
- 汽巴蓝F3GA
- 陕西缔都医药化工有限公司 VIP
- 2026-01-21
- 询价
-

- 汽巴蓝F3GA|T5446|TargetMol
- TargetMol中国(陶术生物) VIP
- 2025-11-17
- ¥294
-
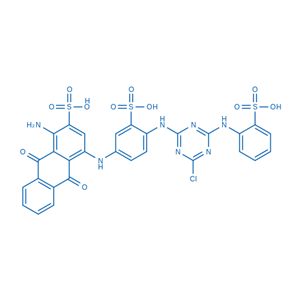
- 汽巴兰3GA
- 烟台盛凯伦化学科技有限公司
- 2024-11-01
- 询价
-
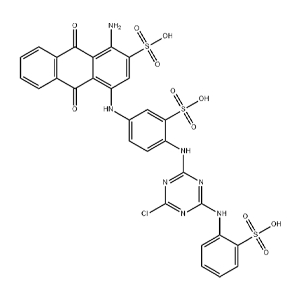
- 汽巴兰3GA
- 阿勒山(广州)生物科技有限公司
- 2022-02-25
- ¥5200