人脐带间充质干细胞无血清培养基(无酚红)
一、产品基本信息
产品名称 | Applied Cell ® 人脐带间充质干细胞无血清培养基 |
货 号 | AC-1001043(PRF) |
规 格 | 基础培养基450mL,添加剂50mL |
运输保存条件 | 基础培养基2-8℃,添加剂-20℃至-80℃;混合后2-8℃ |
使用范围 | 人脐带来源的干细胞原代分离、扩增与传代培养 |
保质期 | 12个月 |
二、产品简介
人脐带间充质干细胞无血清培养基是埃泽思生物(Applied Cell®)自主研发的一款无外源动物成分的人间充质干细胞培养基。可应用于人脐带组织来源的干细胞的原代分离、扩增与传代培养,并保持其多向分化潜能。本产品内毒素水平远低于中国药典标准,生产过程遵循ISO9001体系,并符合GMP指导原则。
人脐带间充质干细胞无血清培养基主要成分:氨基酸,维生素、无机盐、白蛋白,转铁蛋白、胰岛素、微量元素,细胞因子等。
三、产品特性
l 无外源动物蛋白成分,大大降低各类病毒、霉菌和支原体等的污染风险。
l 全程无血清生产,极大降低批次间差异。
l 可用于原代分离,且培养过程无需包被培养板。
l 扩增效率高,24h左右增殖翻倍,节省培养时间。
l 内毒素<0.06EU/ml,远低于中国药典水平
四、产品内容
组分 | 规格 | 数量 | 运输 |
人脐带间充质干细胞无血清基础培养基 | 450mL | 1瓶 | 冰袋 |
人脐带间充质干细胞无血清添加剂 | 50mL | 1瓶 | 干冰 |
五、相关产品
无血清细胞冻存液(治疗级)(Applied Cell®: Cat. no.AC-1001006)
人脐带间充质干细胞(Applied Cell®: Cat. no.AC-2001003) 细胞消化液(Applied Cell®: Cat. no. AC-1001024)
六、实验准备
人脐带间充质干细胞无血清培养基配制
1. 37℃快速解冻人脐带间充质干细胞无血清添加剂,快速溶解时不易破坏添加剂中营养物质,时间大致为10min。待添加剂融化后摇匀,分装或直接按比例添加到基础培养基中,分装后添加剂立即储存于-20℃至-80℃,避免反复冻融 。
2. 将添加剂以10%比例加入到人脐带间充质干细胞无血清基础培养基中,混匀,即为人脐带间充质干细胞无血清培养基(AC-1001043PRF)。混合后培养基可在2-8℃ 稳定储存2-3周,不建议使用已配制超过3周的培养基。
3. 人脐带间充质干细胞无血清培养基可直接应用于人类脐带组织来源的干细胞的原代分离、扩增与传代培养。
4. 预先高温高压灭菌处理剪刀,镊子等实验器械。
5. 预先紫外灭菌超净台/安全柜等实验环境。
七、操作方法(以下步骤皆应在无菌条件下操作)
1. 人脐带间充质干细胞原代分离(贴壁法)
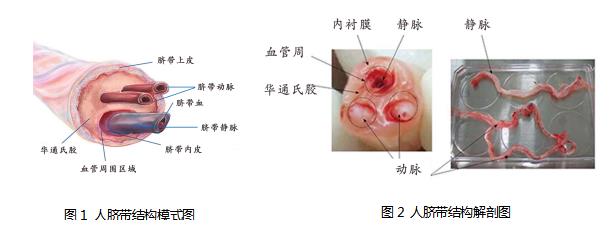
脐带简介:脐带包括脐带血、华通氏胶、两根动脉、一根静脉,所有这些结构被脐带上皮(内衬膜)包裹。脐带是间充质干细胞的主要来源,其中华通氏胶只含有间充质干细胞一种干细胞,是最常用来分离培养间充质干细胞的结构。而内衬膜则含有至少两种干细胞:间充质干细胞和上皮干细胞,这两种干细胞也是细胞治疗的主要来源。
以下方法为从华通氏胶中分离高纯度的间充质干细胞详细步骤:
1.1. 无菌收集长度约10cm的脐带,迅速将脐带放到含有人脐带脂肪保存液(AC-1001016)的50mL离心管中。在4℃条件下快速运到实验室,在4h内处理完成全部过程。
1.2. 将脐带置于生物安全柜中冰盒里放置的直径10cm培养皿中。用预冷的PBS多次清洗脐带,去除残留的血液即止。以下分离组织块的过程确保全程脐带浸泡在预冷PBS中保持湿润。
1.3. 使用剪刀径向剖开脐带,将血管以及周围的华通氏胶暴露出来。
1.4. 用解剖刀将华通氏胶与血管分离,用镊子夹住血管,整条剥离,中间白色部分即华通氏胶(具体人类脐带结构参见图1) 。
1.5. 用剪刀将华通氏胶剪成0.5-1cm见方的薄片组织块,尽量不要太厚。最后剩余的脐带上皮(内衬膜)组织 弃除。
注意:组织块尽量接近片状,增大与培养皿接触面积,提高细胞爬出率
1.6. 每个直径10cm的培养皿中放置10-15个组织块,加入6mL 完全培养基。置于37℃,5%CO2培养箱中培养 不同原代分离体系初始组织块数量以及细胞爬出率见表1。
注意:①为促进组织块贴壁,培养基不能加太多,否则组织块容易漂起
②为促进组织块贴壁,72小时内不能摇晃培养皿,72小时次换液也是同理。

培养们直径 | 初始组织块数量 | 细胞爬出组织块数量 | 细胞爬出率 |
10cm | 16.9 | 11.8 | 69.8% |
表1 脐带组织块粘壁数据(平均数据)
1.7. 每72小时换液。一般5-7天可以看见贴壁组织块附近有细胞爬出,12-15天细胞汇合度达到70%以上,即可准备传代。
1.8. 细胞传代时,用枪头吸掉组织块以及原有培养基,加入5mlPBS清洗一次。每个直径10ml,的培养皿中加入5ml的细胞消化液(AC-1001024 ),摇匀覆盖皿底,37℃恒温箱2-3min或室温3-5min孵育。
1.9. 显微镜下观察到大部分克隆边缘开始脱离皿底,轻轻敲打皿底,细胞呈细沙状脱落,加入同体积完全培养基,用移液枪扇形吹打使细胞完全脱落下来,将细胞悬液收集到15mL离心管中,300×g离心5min。
1.10. 用完全培养基重悬、计数,此时的细胞称为P0代。相关代次预期收获细胞量请参考表2。
1.11. 根据本公司统计数据,10cm长的脐带,约可以收获1.24×107个P0代细胞,一根脐带长度 大约20cm,约可以收获2.5×107个P0代细胞。
1.12. 根据本公司检测,按1:8传代,细胞形态在P10代内不发生变化。P10代以上细胞没有实际应用意义,暂不检测。
1.13. 脐带两端的组织原代分离效率有较大差异,近胎盘端分离效率要高于近胎儿端10-30%。
| P0 | P1 | P2 | P3 | P4 | P5 |
细胞数量 | 1.2×107 | 9.6×107 | 7.7×108 | 6.2×109 | 5.0×1010 | 4.0×1011 |
表2 10cm长的脐带P0-P5代预计收获细胞数量(1:8传代)
2. 人脐带间充质干细胞传代培养
2.1. 在显微镜下观察细胞,细胞汇合度达到90%,即可准备传代;
2.2. 吸掉培养瓶/皿中的培养基,用PBS清洗一次,加入适量的细胞消化液(AC-1001024)覆盖瓶/皿底,37℃恒温箱2-3min或室温3-5min孵育。
2.3. 显微镜下观察到大部分克隆边缘开始脱离瓶/皿底,轻轻敲打瓶/皿底,细胞呈细沙状脱落,加入等倍体积的完全培养基,用移液枪扇形吹打使细胞脱落下来,并轻轻吹打成单细胞,将细胞悬液收集到适当的离心管中,室温300×g 离心5min。
2.4. 弃上清,加入适量完全培养基,重悬细胞,按照比例进行传代或计数后按照1.1-1.45×104个/cm2密度进行接种。均匀铺在培养皿/瓶中,置于37℃,5%CO2 条件下培养。相关数据请见表3。
注意:细胞规模生产建议1:5-1:8传代,一般72小时可以达到90%以上汇合度。
| 清洗PBS体积 | 消化液体积 | 培养基体积 | 接种细胞数量 |
10cm dish | 5ml | 5ml | 10ml | 6.0-8.0×105 |
T25培养瓶 | 3ml | 3ml | 5ml | 2.7-3.7×105 |
T75培养瓶 | 8ml | 8ml | 15ml | 0.8-1.1×106 |
T175培养瓶 | 18ml | 18ml | 35ml | 2.0-3.0×106 |
表3 不同体系建议细胞接种数量及加液量
3. 人脐带间充质干细胞冻存
3.1. 同步骤2.1;
3.2. 同步骤2.2;
3.3. 同步骤2.3;
3.4. 弃上清,用4℃保存的无血清细胞冻存液(治疗级)(AC-1001006)重悬细胞,取部分细胞计数。
注意:无血清细胞冻存液即拿即用,用完之后尽快放回4℃冰箱,以防室温放置太久,影响质量。
3.5. 计数后用无血清细胞冻存液(治疗级)(AC-1001006)调节细胞密度至建议冻存密度1-5×106个/mL,每支冻存管(需提前做好标记)分装1.5-2mL,直接放入-80℃冰箱快速冻存。
3.6. -80℃放置过夜后转移至液氮长期保存。
4. 人脐带间充质干细胞复苏
4.1. 从液氮中取出冻存的hUMSC,37℃水浴快速融解。
4.2. 在生物安全柜或超净台中,先在15mL离心管中加入5 mL 37℃预热的完全培养基,将解冻后的细胞悬液缓慢滴加到离心管中。
4.3. 300×g离心3min,吸掉上清,加入适量完全培养基重悬细胞至建议接种浓度(参考表3)。
4.4. 将细胞悬液均匀滴加到培养瓶/皿中,水平十字振动培养瓶/皿使细胞均匀。置于37℃,5% CO2 条件下培养24小时后观察细胞复苏状态。
4.5. 细胞无异常即可同时更换新鲜的完全培养基继续培养。
4.6. 初次换液后每 48-72小时更换培养液直至传代。
八、人脐带间充质干细胞模式图
九、人脐带间充质干细胞形态图以及分化检测

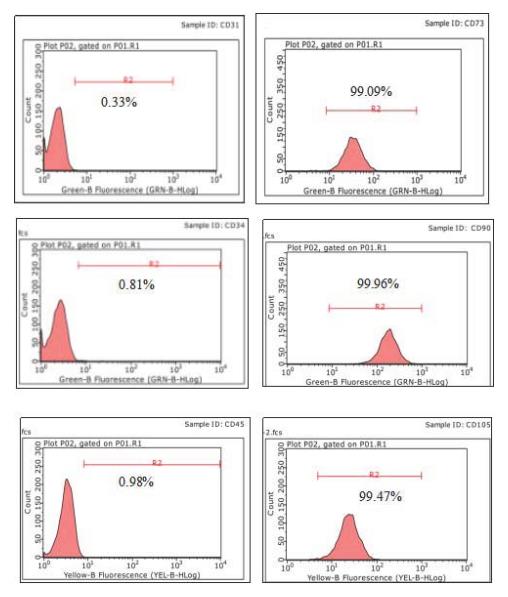
十、人脐带间充质干细胞流式检测
十一、质量控制
检验项目 Test Catagories | 参考数据 Reference Data |
外观 Physical APPearance | 无色液体 Colorless liquid |
澄清度 Clarity | 澄清 Clear |
pH值 Ph Value | 7.0-7.4 |
渗透压 Osmolality | 270-340 (mosm/KgH2O) |
细菌内毒素 Endotoxin | 小于0.06 EU/ml |
无菌 Sterility | 无菌 Sterility |
支原体 Mycoplasma | 0.11um过滤,支原体试验为阴性 The mycoplasma test was negative after 0.11um filtration |
细胞生长试验 Cell growth test | 细胞为梭形,呈指纹状或螺旋状生长 The cells are spindle - shaped, fingerlike or spiral |