
7YR企业会员
发布人:爱必信(上海)生物科技有限公司
发布日期:2026/2/9 17:34:43
IPS诱导肠类器官培养分为三大阶段:人多能干细胞的培养、内胚层分化及中/后肠模式化诱导、类器官培养。
人多能干细胞的培养
一、实验准备:
1、人多能干细胞培养基配制
(1)2-8℃解冻hPSC Medium Supplement,融化后上下晃动混匀,按实际用量进行分装,立即使用或储存于-20~-80℃,避免反复冻融;
(2)按1:50的比例将hPSC Medium Supplement(10mL)加入到hPSC Medium Basal Medium(500mL)中,混合均匀即成为人多能干细胞培养基(abs9403)。
注意:混匀后的人多能干细胞培养基可在2-8℃稳定储存2-3周,不建议使用配制已超过3周的人多能干细胞培养基。
(3) 实验试剂平衡:人多能干细胞培养基实验前放置室温避光平衡;PBS,消化液等 37℃加热。
注意:培养基中含有因子,不要37℃水浴加热。
二、操作方法(以下步骤皆应在无菌条件下操作)
hPSC细胞复苏:
1、实验操作步骤:
1.1、基质胶包被培养板:取出6孔板/12孔板,每孔内加入1mL/0.5mL基质胶(abs9410),轻轻晃动6孔板/12孔板使基质胶完全覆盖皿底,置于37℃培养箱中孵育1h~2h,实验前拿出并置于超净工作台/生物安全柜中室温下平衡20min。如果暂时不用,可用Parafilm封口后2-8℃储存,并于1周内使用。
注意:
①一支冻存的干细胞的数量在1×106cells/mL左右,对应6孔板1孔;
②即用型基质胶对温度敏感,即用即拿,用完后立即放回4℃冰箱保存,且勿用手直接触碰基质胶液面所及的瓶身,影响基质胶质量。
1.2、先将2~3mL的干细胞培养基加入15mL离心管中备用。
1.3、解冻:将从液氮中取出的冻存管快速浸入37℃温水中,快速摇动,使其在1~2min内快速解冻;
注意:细胞从液氮中拿出的速度要快,尽量减少其暴露在室温中的时间。
1.4、离心:冻存管中的冻存液解冻后,将其逐滴加入含有干细胞培养基的15mL离心管中,将15mL离心管置于低速离心机中配比平衡后,1000rpm离心3min;
1.5、重悬:离心后弃上清加1mL人多能干细胞培养基对干细胞沉淀进行吹吸混匀,吹吸3~5次左右。
1.6、接种:吹吸均匀后,将已经平衡好的即用型基质胶弃掉,将吹打均匀的干细胞悬液加入到已经包被好的6孔板中,并补全每孔2mL培养体系。
1.7、培养:接种后的6孔板可以置于倒置相差显微镜下观察接种的干细胞密度以及细胞团块大小,呈4个细胞以上的团块较合格,水平十字轻轻晃动6孔板/12孔板使细胞均匀分布。并置于37℃,5%CO2的恒温培养箱培养,第2天观察细胞贴壁情况;
1.8、换液:从复苏的时间开始每24h换液一次。
注意:因培养基中活性成分只足够维持一天,所以每24h应及时更换新鲜培养基。
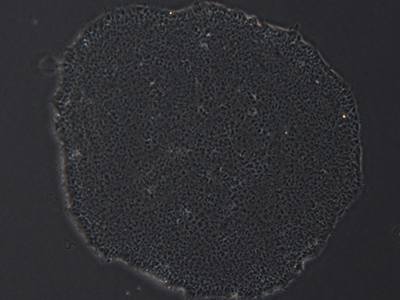
多能干细胞(PSCs)集落
hPSC 细胞传代:
2、实验具体操作步骤:
2.1、清洗:吸掉原有培养基,贴壁缓慢加入1mL PBS缓冲液并轻轻晃动,然后沿培养皿边缘吸去PBS缓冲液;
2.2、消化:在6孔板中加入2mL/孔人多能干细胞消化液(abs9409)使之覆盖皿底,并置于37℃培养箱中2~5min;
注意:消化时间依据干细胞生长密度,消化时间略有不同,根据经验一般建议时间2-5min。消化过程中可以拿到倒置显微镜下观察细胞消化情况,若在显微镜下观察到大部分克隆边缘以及克隆内部细胞间出现间隙,即可吸掉消化液终止消化。
2.3、吹打:吸掉消化液后,加入2mL人多能干细胞培养基,用移液枪扇形吹打培养皿底,轻柔吹打3~5次,使皿底干细胞集落脱落,并将其并转移到15mL离心管中;
注意:吹吸皿底细胞的力度要轻柔,吹打脱落和吹吸混匀的次数在3~5次为宜,尽量避免形成单细胞。如有少量细胞无法从皿底脱落,属于正常现象。如有大量细胞无法从皿底脱落,需延长消化时间。
2.4、离心:1000rpm离心3min,弃上清;
2.5、接种:用干细胞培养基吹打细胞5-10次,吸掉包被培养板中的基质胶,并将细胞悬液加入到培养板中,且补全每孔2mL的培养体系。
注意:吹打细胞要温柔,并且吹打次数不要超过10次。
2.6、换液:从传代的时间开始每24h换液一次。
注意:因培养基中活性成分只足够维持一天,所以每24h应及时更换新鲜培养基。
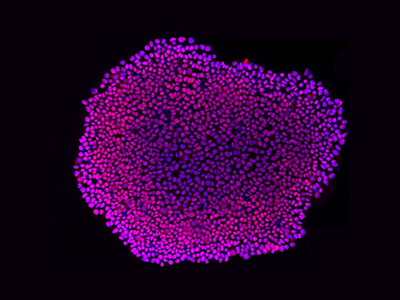
多能干细胞(PSCs)集落染色图
hPSC细胞冻存
3、实验具体操作步骤:
3.1、清洗:同2.1;
3.2、消化:同2.2;
3.3、吹打:同2.3;
3.4、离心:同2.4;
3.5、重悬:离心后弃上清,加入2mL ES/iPS细胞冻存液(abs9412)对干细胞沉淀进行吹吸混匀,吹吸3~5次后,将其加入到冻存管中;
注意:冻存液即用即拿,及时放回4℃冰箱。
3.6、记录:在冻存管上标记冻存细胞种类、时间、操作者及细胞批次。
3.7、-80℃冰箱冻存:冻存管置于-80℃冰箱过夜。
注意:冻存管放置于-80℃冰箱时,要将冻存管直立放置,切忌冻存管斜放或横放。
3.8、液氮冻存:24h后将-80℃冰箱中的细胞转移至液氮中长期冻存。
内胚层分化及中/后肠模式化诱导
一、前期准备
1、试剂与设备
- 细胞:H1/H9 hESC或患者来源iPSCs。
- 培养基:人多能干细胞培养基(abs9403)、RPMI 1640(abs9484)。
- 消化液:人多能干细胞消化液(abs9409)
- 培养基添加剂:L-丙氨酰-L-谷氨酰胺溶液(2mM)(abs9295)、双抗(abs9244)
- 生长因子:Activin A(100ng/mL)(abs05801)、FGF4(500ng/mL)(abs06269)、WNT3a(500ng/mL)(abs05632)。
- 基质胶:即用型基质胶(培养板包被)(abs9410)、类器官专用基质胶(abs9495)。
- 血清:透析胎牛血清(abs945)
- 关键设备:表面培养皿、立体显微镜、无菌手术刀、预冷微量离心管。
2、试剂配制
- 内胚层分化培养基:
- Day1:RPMI 1640+L-丙氨酰-L-谷氨酰胺溶液(2mM)+双抗(1%)+Activin A(100ng/mL)。
- Day2:Day1配方+透析胎牛血清(0.2%)。
- Day3:Day1配方+透析胎牛血清(2%)。
- 中/后肠分化培养基:
-RPMI 1640+透析胎牛血清(2%)+FGF4(500ng/mL)+WNT3a(500ng/mL)。
二、hPSCs传代与铺板
1、细胞传代(耗时2h)
- 使用人多能干细胞消化液消化hPSCs至边缘卷起。
- 用细胞刮刀轻柔剥离细胞团,反复吹打至1-2mm大小细胞团。
- 按1:6比例接种至Matrigel包被的24孔板(每孔约5000个细胞团)。
- 轻敲培养板使细胞均匀分布,37°C过夜培养。
2、细胞扩增至85-90%融合(3-4天)
- 每日更换人多能干细胞培养基,观察细胞密度。
- 关键:密度过高(自发分化)或过低(分化效率低)需重新铺板。
三、内胚层分化(3天)
1、Day1:吸除人多能干细胞培养基,加入Day1内胚层培养基(无血清),培养24h。
2、Day2:更换为Day2内胚层培养基(含0.2%透析胎牛血清),培养24h。
3、Day3:更换为Day3内胚层培养基(含2%透析胎牛血清),培养24h。
4、验证分化效率(可选):
- 免疫染色检测FOXA2/SOX17双阳性细胞(效率应达85-90%)。
四、中/后肠模式化(3-4天)
1、诱导球状体形成
-吸除内胚层培养基,加入中/后肠分化培养基,每日更换。
-48h后:立体显微镜下观察上皮增厚,72-96h球状体(spheroids)脱离单层细胞。
2、收集球状体
-用200μL枪头收集游离球状体,每管约50个,置于冰上备用。
类器官培养(14-28天)
原代
一、准备工作
试剂耗材
人正常肠类器官培养试剂盒(abs9545),基质胶(低因子、无酚红)(abs9495),15ml离心管(abs7102),1.5ml EP管若干(abs7119),24孔细胞培养板(abs7035)、金属冰盒。

组分名称
规格
类器官培养基 A
100ml
类器官原代培养缓冲液 B
250ml
原代组织消化液 C
30ml
类器官传代消化液 D
30ml
组织保存液 E
100ml
类器官冻存液 F
20ml
类器官传代培养缓冲液 G
250ml
二、操作流程
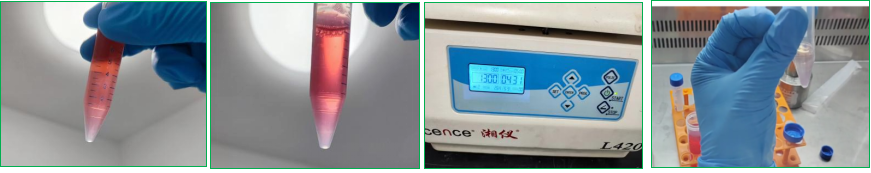
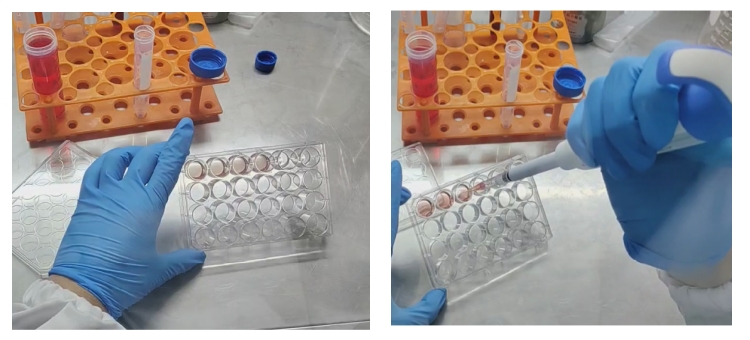
1、加胶-点板-加液(这里是整个原代操作的点睛之笔)
(1)准备工作
a 基质胶需用金属冰盒盛放在4℃冰箱过夜融化;
b 枪头、离心管需要-20℃提前预冷至少半小时;
c 融化后的基质胶可一直放4℃储存,建议2周内用完。

低温金属冰盒(abs7289)
(2)接种要求
24孔板(abs7035),每孔25ul基质胶球状体混合物,500-750uL类器官培养基。
(3)接种密度
密度建议1:基质胶总体积:球状体总体积=25:1(如果估摸细胞团沉淀体积困难,通常加300uL基质胶足够)
密度建议2:50个球状体/25uL基质胶(如果想计数接种,可以参照此密度建议)
(4)加胶-点板
向细胞团沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
(5)加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μl类器官培养基A进行培养。大概10-14天,多数类器官直径在200um-500um,可进行传代操作。
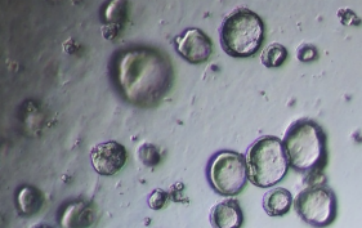
铺板密度
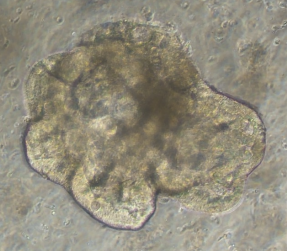
小肠类器官生长图
传代(消化分两种情况)
一、类器官数量较多或体积较大传代步骤
1、类器官收集及洗涤
1)收集:移液器吸去培养基,每孔添加1-2ml左右4℃类器官传代培养缓冲液G,轻柔吹散基质胶,收集在15ml离心管中(24孔板,每5孔为一组)。
2)洗涤:加类器官传代培养缓冲液G定容至14ml(缓冲液越多,基质胶被稀释的越充分,越容易去除),4℃静置 40min或-20℃放置5min(目的是使基质胶软化,如果冰箱保温效果强,缩短冷冻时间,摸索合适的冷冻时间时,可取出离心管摇晃看不到基质胶说明冷化好了)。
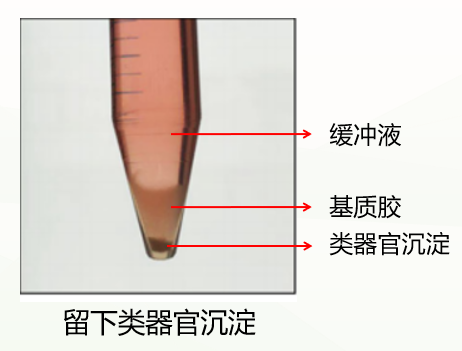
3)接下来将离心管进行300g,4℃, 离心5min,离心完通常会有这两种情况:
第一种是正常情况,分成三层(如下图),此时弃掉上清和基质胶层,保留类器官沉淀即可。
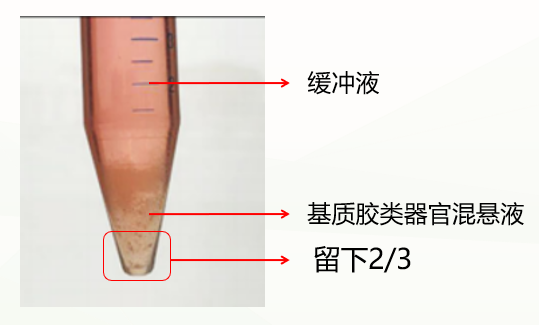
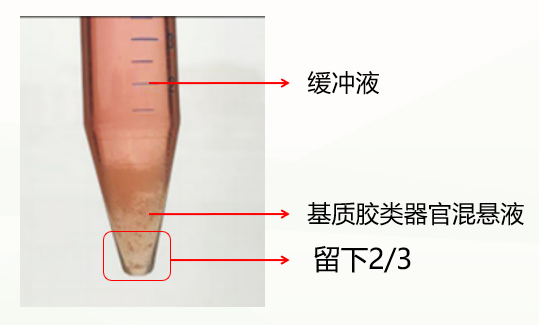
第二种是不正常情况,分成两层(如下图),这种情况可能与冷化不充分有关。此时弃掉缓冲液,留下基质胶类器官混悬液,重复上一步洗涤步骤,再次冷化离心,通常能出现清晰分层(缓冲液层、基质胶层、类器官沉淀层),此时弃掉上清和基质胶层,保留类器官沉淀即可。如果依然是两层(缓冲液层和基质胶类器官混悬液层),此时弃掉缓冲液和上1/3的基质胶类器官混悬液,保留下2/3即可。
促进基质胶和类器官有效分离条件:
a离心机的选择非常重要,水平角离心机相比固定角离心机更利于基质胶和类器官分离;
b离心机的温度最好是4℃(可避免基质胶固化),离心转速可适当提高(最高不要超过500g),离心时间可适当加长(最常不超过10min)。
2、类器官消化
1)添加2-3mL类器官传代消化液D于超净台内消化2-3min,消化期间吹打1-2次。此步骤以消化成细胞团为主,千万不要消化成单细胞,单细胞类器官存活率低。如果不确定是否消化适宜,可吸取数微升镜下观察,如果有较多细胞团可停止消化。
2)添加5倍类器官传代培养缓冲液G(缓冲液:消化液=5:1)终止消化,300g 4℃ 离心 5min 弃去上清(如果有基质胶残留,残留量<50ul正常,不影响传代类器官增殖)
3、加胶-点板-加液
(1)准备工作
a 基质胶需用金属冰盒盛放在4℃冰箱过夜融化;
b 枪头、离心管需要-20℃提前预冷至少半小时;
c 融化后的基质胶可一直放4℃储存,建议2周内用完。
(2)接种要求
24孔板(abs7035),每孔25ul基质胶细胞团混合物,500-750uL类器官培养液。
(3)接种密度
密度建议1: 类器官通常按1:2传代,例如,24孔板收集5孔,传代10孔,需要的基质胶量25*10=250ul
密度建议2:500个细胞团/25uL基质胶(如果想计数接种,可以参照此密度建议)
注意:不管是按密度建议1还是,密度建议2,如果有残留的基质胶,新胶量至少是残留胶量的1.5倍
(4)加胶-点板
向细胞团沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
(5)加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μl人肠癌类器官培养基 A进行培养。大概10-14天,多数类器官直径在200-300um,可进行传代操作。
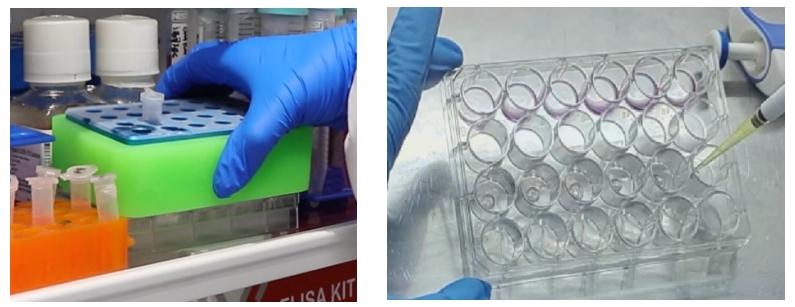
二、类器官数量不足或体积较小时:
1、类器官收集、吹打、洗涤
1)移液器吸去培养基,每孔添加 1-2ml 左右4℃类器官传代培养缓冲液G,轻柔吹散基质胶。
2)进行吹打,将类器官吹成细胞团(可取样镜下观察有较多细胞团时可停止吹打);
3)洗涤: 24孔板,每5孔为一组,收集在 15ml 离心管中,加类器官传代培养缓冲液G定容至14ml(缓冲液越多,基质胶被稀释的越充分,越容易去除),4℃静置 40min或-20℃放置5min(目的是使基质胶软化,如果冰箱保温效果强,缩短冷冻时间,摸索合适的冷冻时间时,可取出离心管摇晃看不到基质胶说明冷化好了)。
4)接下来将离心管进行300g,4℃, 离心5min,离心完通常会有这两种情况:
第一种是正常情况,分成三层(如下图),此时弃掉上清和基质胶层,保留细胞团沉淀即可。
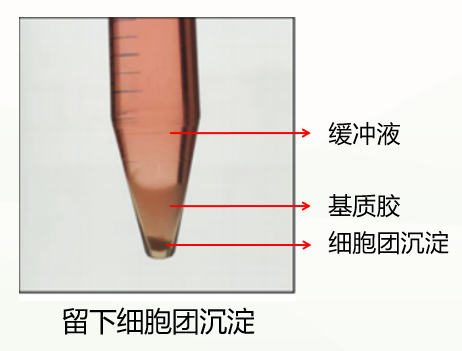
第二种是不正常情况,分成两层(如下图),这种情况可能与冷化不充分有关。此时弃掉缓冲液,留下基质胶类器官混悬液,重复上一步洗涤步骤,再次冷化离心,通常能出现清晰分层(缓冲液层、基质胶层、类器官沉淀层),此时弃掉上清和基质胶层,保留类器官沉淀即可。如果依然是两层(缓冲液层和基质胶细胞团混悬液层),此时弃掉缓冲液和上1/3的基质胶细胞团混悬液,保留下2/3即可。
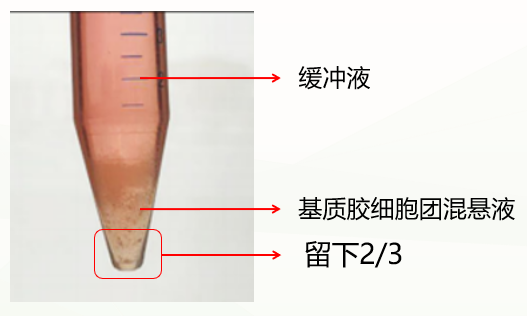
促进基质胶和类器官有效分离条件:
a 离心机的选择非常重要,水平角离心机相比固定角离心机更利于基质胶和类器官分离;
b 离心机的温度最好是4℃(可避免基质胶固化),离心转速可适当提高(最高不要超过500g),离心时间可适当加长(最常不超过10min)。
2、加胶-点板-加液
(1)准备工作
a 基质胶需用金属冰盒盛放在4℃冰箱过夜融化;
b 枪头、离心管需要-20℃提前预冷至少半小时;
c 融化后的基质胶可一直放4℃储存,建议2周内用完。
(2)接种要求
24孔板(abs7035),每孔25ul基质胶细胞团混合物,500-750uL类器官培养液
(3)接种密度
密度建议1: 对于类器官数量较少的情况,为了维持生长所需的旁分泌信号,需要2-3孔富集到1孔,例如,24孔板收集6孔,2孔富集1孔,铺3孔,需要的基质胶量25*3=75uL
密度建议2:500个细胞团/25uL基质胶(如果想计数接种,可以参照此密度建议)
注意:不管是按密度建议1还是按密度建议2,如果有残留的基质胶,新胶量至少是残留胶量的1.5倍
(4)加胶-点板
向细胞团沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
(5)加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μl类器官培养基 A进行培养。大概7-10天,多数类器官直径在200-300um,可进行再次传代。
冻存
冻存要领:
类器官不需要消化(消化后的类器官复苏活率低);
在类器官指数增长期冻存(等到该传代的时候类器官活性比指数期差),也就传代后的Day3-Day4,多数类器官直径在100um-200um,这个时机选择冻存。
一、类器官收集及洗涤
1、收集:移液器吸去培养基,每孔添加 1-2ml 左右4℃类器官传代培养缓冲液G,轻柔吹散基质胶,收集在 15ml 离心管中(24孔板,每5孔为一组)。
2、洗涤:加类器官传代培养缓冲液G定容至14ml(缓冲液越多,基质胶被稀释的越充分,越容易去除),4℃静置 40min或-20℃放置5min(目的是使基质胶软化,如果冰箱保温效果强,缩短冷冻时间,摸索合适的冷冻时间时,可取出离心管摇晃看不到基质胶说明冷化好了)。
3、接下来将离心管进行300g,4℃, 离心5min,离心完通常会有这两种情况:
第一种是正常情况,分成三层(如下图),此时弃掉上清和基质胶层,保留类器官沉淀即可。

第二种是不正常情况,分成两层(如下图),这种情况可能与冷化不充分有关。此时弃掉缓冲液,留下基质胶类器官混悬液,重复上一步洗涤步骤,再次冷化离心,通常能出现清晰分层(缓冲液层、基质胶层、类器官沉淀层),此时弃掉上清和基质胶层,保留类器官沉淀即可。如果依然是两层(缓冲液层和基质胶类器官混悬液层),此时弃掉缓冲液和上1/3的基质胶类器官混悬液,保留下2/3即可。
促进基质胶和类器官有效分离条件:
a 离心机的选择非常重要,水平角离心机相比固定角离心机更利于基质胶和类器官分离;
b 离心机的温度最好是4℃(可避免基质胶固化),离心转速可适当提高(最高不要超过500g),离心时间可适当加长(最常不超过10min)。
二、类器官冻存
1、冻存密度,以24孔板为例
密度建议1:2孔/mL 冻存液
密度建议2:500个类器官/mL 冻存液(如果想计数冻存,可以参照此密度建议)
2、添加适量类器官冻存液 F,轻柔吹打重悬,建议立即进行冻存。(放置太久,DMSO对类器官有损伤)
3、梯度冻存:将冻存管放入梯度冻存盒然后保存至-80℃过夜,第二天取出放入液氮罐。
手动冻存:4℃冰箱放置30 min,转移至-20℃放置1h,然后移至-80℃过夜,第二天取出放入液氮罐。
复苏
一、实验前准备
1、将水浴锅预热至37℃;
2、细胞实验室进行常规消毒,用预防喷雾喷涂并且使用紫外线照射40min的超净工作台台面;
3、在超净工作台中按次序摆好消过毒的离心管、吸管、培养板等。
二、取出冻存管
1、根据类器官冻存记录按标签找到所需类器官的编号。
2、从液氮罐中取出冻存盒,取出所需的冻存管,同时核对冻存管外的编号。
三、迅速解冻
1、迅速将冻存管投入到已经预热的水浴锅中解冻,并要不断地摇动,使管中地液体迅速融化。
2、约1-2min后冻存管内液体完全溶解,取出用酒精棉球擦拭冻存管地外壁,再拿入超净台内。
四、将类器官冻存液移入15ml离心管,添加10倍体积类器官传代培养缓冲液 G(缓冲液体积:冻存液体积=10:1)重悬,轻柔吹打混匀,300g 4℃ 离心 5min,弃上清。
五、加胶-点板-加液
1、准备工作
(1)基质胶需用金属冰盒盛放在4℃冰箱过夜融化
(2)枪头、离心管需要-20℃提前预冷至少半小时
(3)融化后的基质胶可一直放4℃储存,建议2周内用完
2、复苏要求
24孔板(abs7035),每孔25ul基质胶类器官混合物,500-750uL类器官培养液
3、复苏密度
复苏密度建议1:1:1接种(原来冻几孔就复苏几孔)
复苏密度建议2:250个类器官/25uL基质胶(如果想计数接种,可以参照此密度建议)
4、加胶-点板
向类器官沉淀加入基质胶(abs9495),进行吹打混匀(不要满吹满打,容易产生气泡),然后进行点板。整个操作在金属冰盒或冰上进行。操作熟练以后,加胶,混匀,点板控制在半分钟内,有利于保持基质胶良好的流畅性。
5、加液
将铺好的培养板放入37℃培养箱中40-60min成胶,添加500-750μl类器官培养基 A进行培养。大概10-14天,多数类器官直径在200um-500um,可进行传代操作。
关键注意事项
1、Matrigel操作:全程冰上操作,避免提前固化。
2、密度控制:内胚层分化前细胞需达85-90%融合,否则影响球状体形成。
3、生长因子活性:使用新鲜配制或分装保存的因子,避免反复冻融。
4、污染防控:无菌操作,定期检测支原体。
常见问题与解决(Troubleshooting)
通过严格遵循上述步骤并优化细节,可高效生成功能性人类肠道类器官,适用于疾病建模、药物筛选等研究。
今天讲解就到这了,大家如有实验问题,欢迎一起交流哦!
本期小爱推荐
货号
品名
规格
Absin产品线:
爆款产品:十大试剂盒(mIHC、IHC、凋亡、ELISA、ChIP、Co-IP、TR-FRET、生化检测、残留检测、多因子检测);细胞培养(类器官试剂盒+基质胶,胎牛血清+培养添加剂+细胞因子)、分化试剂盒;分子(mRNA合成服务+提取试剂盒);化合物大包装;辅助试剂、耗材/仪器、定制服务(抗体/多肽/蛋白/标记/检测)...
特色产品:鸡胚提取物CEE、B27、N2、霍乱毒素B亚单位CTB、牛脑垂体提取物BPE、百日咳毒素PTX、重组人胰岛素Insulin、人源低密度脂蛋白LDL...
爱必信(上海)生物科技有限公司
联系邮箱:info@absin.cn
微信公众号:爱必信生物
.jpg)
相关新闻资讯