一、研究背景与意义
细胞焦亡是一种由gasdermin(GSDM)蛋白家族介导的程序性细胞死亡方式,在宿主防御及炎症性疾病发生发展中起关键作用。该家族成员(如人类的GSDMA至GSDME)通过其活化后的N端结构域在细胞膜上形成孔道,导致细胞裂解并释放促炎因子。其中,GSDMD是炎症性细胞焦亡的核心执行者。其N端片段(GSDMD-NT)形成的膜孔道不仅直接引发细胞破裂、加剧局部炎症,还可通过胞外囊泡等方式将损伤信号扩散至邻近组织,从而推动系统性炎症反应或细胞因子风暴的发展。
然而,针对GSDMD-NT孔道的药物研发面临多重挑战。首先,该孔道在形成过程中存在显著的结构动态性,难以获得稳定的蛋白质构象以供传统高通量筛选。其次,其孔径较大(约21纳米),小分子化合物难以实现有效封堵。此外,GSDMD在免疫稳态中亦具有生理功能,完全抑制其活性可能带来不良影响。因此,开发能够可逆、精准作用于成熟孔道的调控分子,是当前该领域的重要研究方向。
近期,一项发表于《自然·免疫学》的研究在此方向取得重要进展。该研究团队利用人工智能技术进行从头设计,成功获得一种能够特异性结合并阻断GSDMD-NT孔道的多肽分子——SK56。实验表明,该多肽可有效延缓细胞焦亡进程,并显著减轻由此引发的炎症反应。这一发现为脓毒症、慢性炎症及自身免疫性疾病等由过度或持续炎症驱动的病理状态,提供了具有潜力的新型干预策略与治疗选择。

二、靶向GSDMD孔道的治疗逻辑与技术挑战
在细胞焦亡的分子通路中,Gasdermin D(GSDMD)扮演着最终执行者的关键角色。当细胞感知到病原或危险信号时,炎症小体被组装并激活Caspase-1蛋白酶。活化的Caspase-1对GSDMD进行特异性切割,释放出其N端结构域(GSDMD-NT)。该结构域随后转运至细胞膜,并通过寡聚化形成直径约21纳米的跨膜孔道,此过程标志着细胞焦亡进入不可逆的执行阶段。从干预策略角度看,GSDMD介导的孔道形成是上游多种信号通路的汇聚节点与共同下游,针对此类“最终共同通路”进行靶向调控,理论上能够高效阻断焦亡进程及其引发的病理效应。
GSDMD孔道的形成直接导致两个关键后果:一方面,细胞膜完整性丧失,促使已成熟的炎症因子如IL-1β和IL-18大量释放,进而放大局部及全身性炎症反应;另一方面,细胞内离子稳态失衡,引起水分内流、细胞肿胀直至膜破裂。因此,从机制上干预孔道形成或功能,被视为从源头遏制细胞焦亡及其相关病理损伤的潜在治疗策略。
然而,针对GSDMD孔道进行药物开发面临显著的技术瓶颈。该孔道具有结构动态性强、表面缺乏典型疏水结合口袋、且整体呈现负电性等特点,使得传统小分子难以实现高效与特异性结合。此外,由于孔道蛋白在天然状态下构象不稳定,难以制备适用于常规高通量筛选平台的稳定靶标蛋白,这进一步限制了基于经典筛选方法(如基于结构的虚拟筛选或生化水平结合实验)的候选分子发现。这些因素共同使得GSDMD孔道成为一个极具挑战性的药物靶点。
三、基于人工智能的GSDMD孔道拮抗多肽从头设计策略
针对GSDMD孔道缺乏传统可成药性结合位点这一挑战,研究人员转向了基于人工智能的从头设计策略,以直接构建能够特异性靶向并阻断该孔道的分子。
✔️靶点特性与设计挑战
由于GSDMD孔道表面缺乏明确的小分子结合口袋,且其精确的配体结合模式未知,传统的基于已知化学库或天然底物的发现方法难以适用。因此,研究的关键在于从理论上反向推导出与该孔道表面实现最佳互补性相互作用的理想配体特征。
✔️计算模型的构建与训练
为解决此问题,研究采用了一种经过改造的深度学习模型(基于Transformer架构)。该模型首先接受了大规模的蛋白质-蛋白质复合物结构数据的训练,学习其中决定界面结合特性的物理化学规律与空间几何约束。这一过程使模型内化了生物分子相互作用的底层原理。
✔️“理想配体”界面的反向生成
训练完成后,研究人员将目标——GSDMD-NT孔道的三维结构信息(包括原子坐标、类型及静电势分布)输入该模型。模型并非进行筛选,而是基于其学习到的相互作用法则,直接逆向生成一个理论上能与该孔道表面形成最优结合的“互补性相互作用界面”的原子点云图。此点云图本质上描绘了一个理想化配体在其结合构象中应具备的关键原子排布与化学性质,为后续设计提供了精确的“蓝图”。
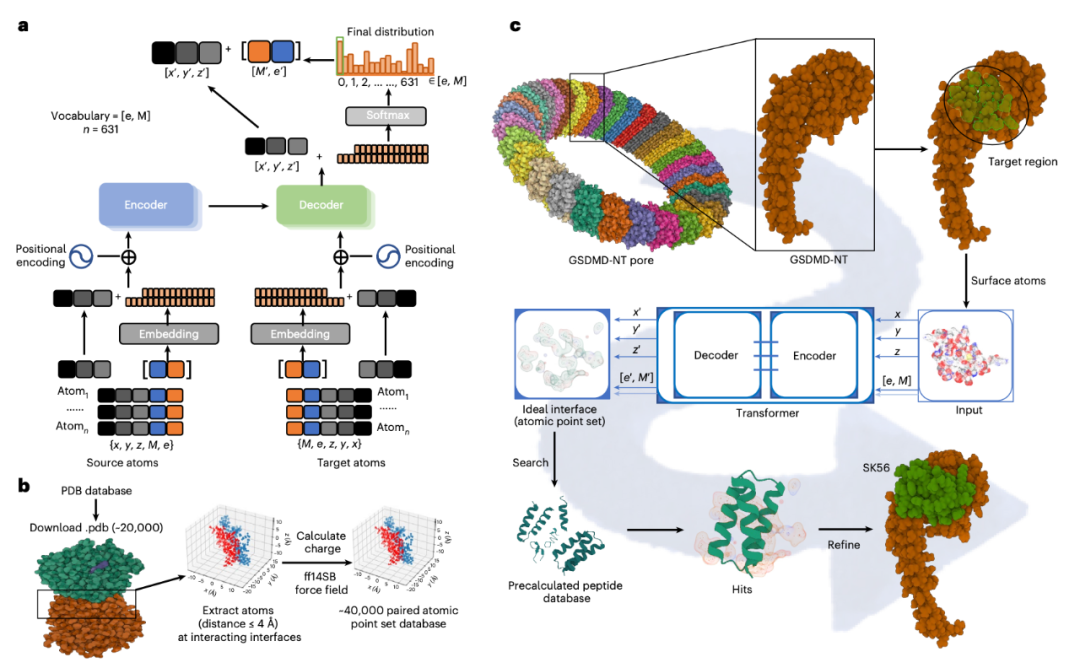 Fig 1 Peptide screening using the Transformer model to identify GSDMD NT pore blockers.
Fig 1 Peptide screening using the Transformer model to identify GSDMD NT pore blockers.
✔️从蓝图到实体分子的实现
依据此计算生成的理想界面蓝图,研究团队在一个预先定义的多肽结构空间中进行检索与匹配,筛选出骨架与之最为接近的候选序列。通过对这些候选分子进行进一步的优化与严格的体外及细胞功能验证,最终鉴定出具有高效阻断活性的多肽分子(如SK56)。这一方法学将传统的“筛选发现”模式转变为“按需设计”的理性构建模式,显著提升了针对此类难成药靶点的先导分子发现效率。
四、多肽SK56阻断GSDMD孔道功能的作用机制验证
在获得候选多肽SK56后,研究通过多层次、递进式的实验体系,系统地验证了其功能与作用机制,以确证其作为GSDMD孔道特异性阻断剂的有效性。
👉细胞表型与功能验证
研究首先在细胞水平进行了功能评估。在巨噬细胞焦亡模型中,添加SK56能显著抑制关键炎症因子IL-1β的释放。同时,活细胞成像结果显示,SK56可将细胞膜破裂的发生时间延迟约40分钟。这些数据初步证实了SK56在细胞层面具备延缓焦亡进程、减轻炎症输出的生物活性。
👉上游信号通路排除与作用窗口锁定
为阐明SK56的作用环节,研究检测了其对焦亡上游关键事件的影响。蛋白质印迹分析表明,SK56的处理并不影响Caspase-1对GSDMD的切割,也不影响pro-IL-1β向成熟IL-1β的加工过程,但能有效阻止成熟IL-1β的胞外释放。该结果将SK56的作用精确锁定在“GSDMD被切割形成孔道之后”与“炎症因子释放之前”的窗口期,排除了其干扰上游活化通路的可能性,初步支持其作为孔道直接阻断剂的假说。
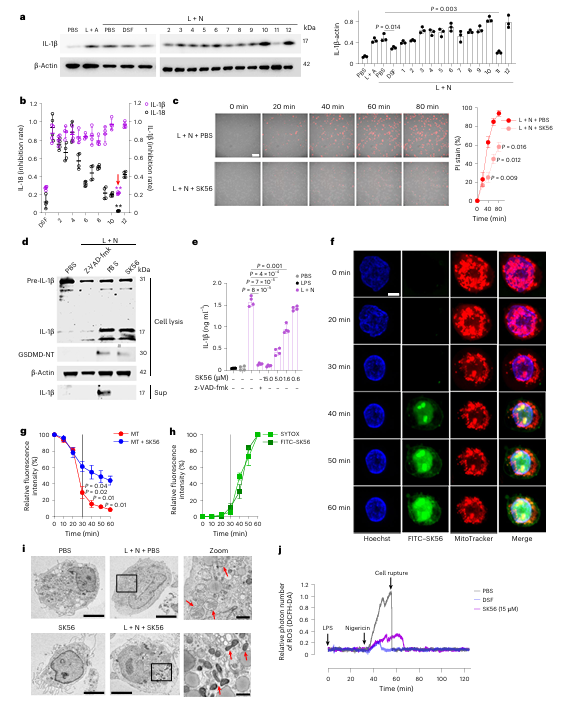 Fig. 2 | SK56 delays pyroptosis and IL-1β release and prevents mitochondrial damage without affecting cleavage of GSDMD or IL-1β.
Fig. 2 | SK56 delays pyroptosis and IL-1β release and prevents mitochondrial damage without affecting cleavage of GSDMD or IL-1β.
👉靶点直接相互作用的证实
为提供SK56直接作用于孔道的物理证据,研究采用了生物膜层干涉技术与免疫共沉淀方法。数据显示,SK56特异性结合于含有GSDMD-NT孔道的焦亡细胞膜,而不与正常细胞膜或可溶性GSDMD-NT单体结合。同时,成功捕获了SUMO标签化的SK56与GSDMD-NT孔道的复合物,从生化层面直接证实了两者间的特异性相互作用,为作用机制提供了关键支撑。
👉关于靶点选择性的讨论
值得注意的是,进一步的结合力分析揭示,SK56对GSDMD-NT与其他gasdermin家族成员(如GSDMC-NT)表现出相近的体外亲和力。这提示该多肽可能对特定gasdermin亚型的选择性有限。尽管在本研究聚焦的经典炎症模型中,GSDMD是主导执行的蛋白,但此交叉反应性提示在涉及其他gasdermin家族成员活化的不同病理背景下,需对其作用的特异性进行审慎评估。此发现也为未来开发更高选择性的孔道抑制剂指明了优化方向。
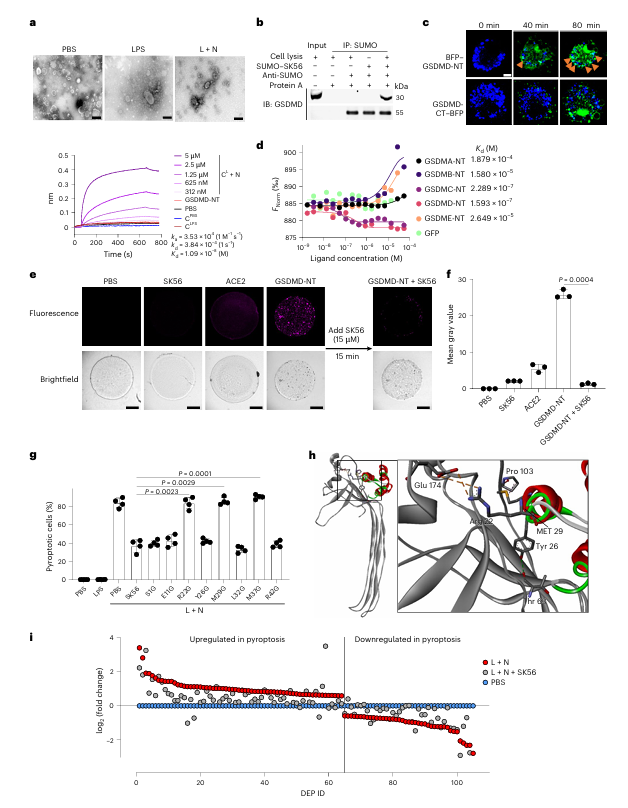
Fig. 3 | SK56 inhibits pyroptosis by directly targeting GSDMD pore function.
五、多肽SK56的功能特性验证与体内疗效评估
为阐明SK56相比现有干预策略的潜在优势,并评估其体内应用前景,研究通过复杂体外模型与动物实验进行了系统探究。
✔️区分干预阶段:阻断成熟孔道的独特功能
既往研究表明,部分小分子(如双硫仑)可通过共价修饰GSDMD的半胱氨酸残基,抑制其孔道形成。为明确SK56的独特作用机制,研究构建了巨噬细胞-肺泡类器官共培养体系。该模型显示,焦亡巨噬细胞可释放携带活性GSDMD孔道的膜囊泡,进而引发邻近类器官细胞的死亡,即“旁观者效应”。在此模型中,作用于孔道形成阶段的抑制剂无法逆转已形成的孔道损伤,而SK56作为成熟孔道的直接阻断剂,则能有效保护类器官细胞免受攻击。该实验不仅证明了SK56能够干预孔道形成后的病理过程,也揭示了阻断成熟孔道在遏制焦亡扩散中的关键作用。
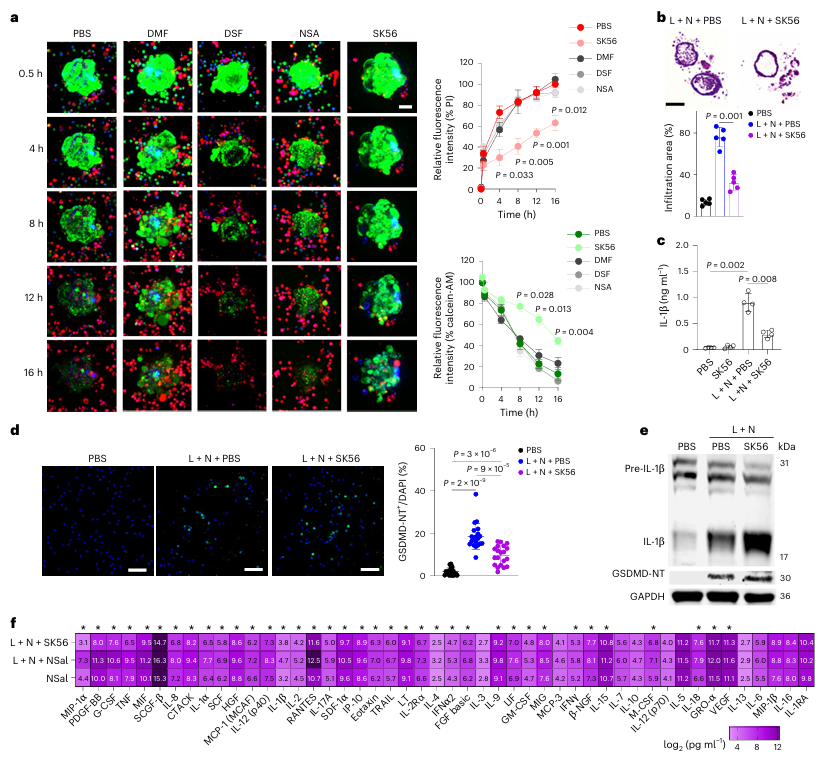 Fig. 5 | SK56 protects human alveolar organoids and blood leukocytes from pyroptosis-induced damage.
Fig. 5 | SK56 protects human alveolar organoids and blood leukocytes from pyroptosis-induced damage.
✔️动物模型中的疗效验证
研究进一步在脂多糖诱导的脓毒症小鼠模型中评估了SK56的治疗潜力。在轻度脓毒症模型中,即便在炎症启动后延迟给药(如16小时),SK56仍能显著提升小鼠存活率。该结果提示,针对执行阶段的干预在疾病一定时间窗内可能仍具治疗价值。
✔️实验设计与结论的审慎考量
需要指出的是,在更为严重的脓毒症模型中,SK56的保护效应有所减弱。此外,研究在比较SK56与其它抑制剂(如双硫仑)的疗效时,采用了不同的给药途径(静脉注射对比腹腔注射)。由于给药途径直接影响药物的系统暴露与生物利用度,此类比较在严谨性上存在局限,其得出的“优越性”结论需结合更对等的药代动力学参数进行审慎解读。
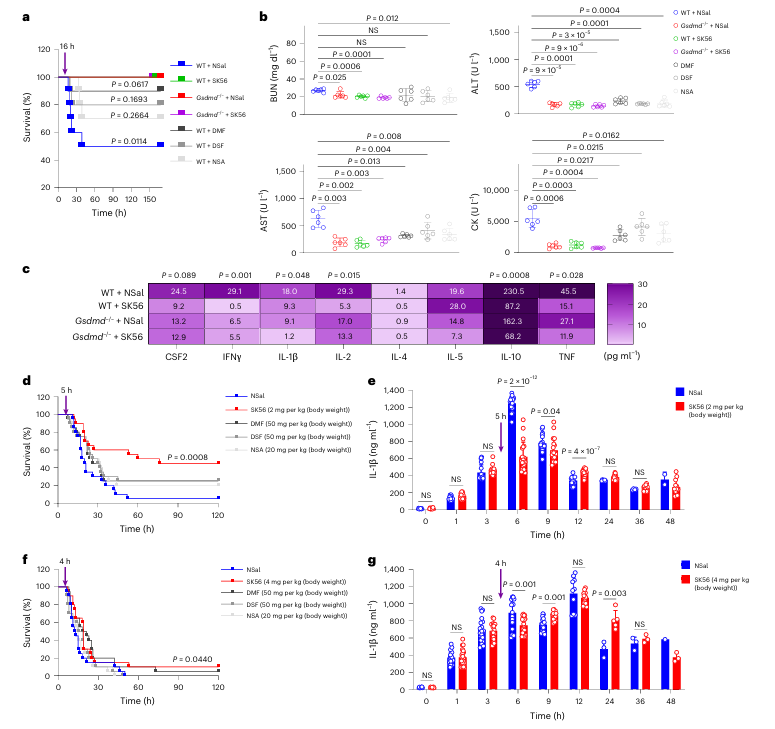 Fig. 6 | SK56 improves survival in LPS-induced sepsis in mice.
Fig. 6 | SK56 improves survival in LPS-induced sepsis in mice.
✔️作用逻辑归纳
综合而言,本研究构建了一条从分子设计到体内验证的完整逻辑链:通过人工智能设计获得多肽SK56;该多肽可特异性结合并物理性阻断已形成的GSDMD-NT孔道;从而抑制炎症因子释放与细胞膜破裂,并阻断焦亡相关的“旁观者”损伤;最终在脓毒症模型中展现出减轻组织损伤、改善生存预后的治疗潜力。这为开发靶向细胞焦亡执行阶段的治疗策略提供了新的思路与实验依据。

