
2YR企业会员
发布人:普健生物(武汉)科技有限公司
发布日期:2026/2/11 10:34:05
在人体免疫系统的“防御军团”中,巨噬细胞是兼具“作战”与“修复”能力的核心成员。巨噬细胞广泛分布于全身组织,既能在病原体入侵时奋勇清除“外敌”,又能在组织损伤后参与修复重建。而赋予其双重能力的关键,正是“极化”这一独特的功能转换机制。巨噬细胞可随微环境信号“切换”表型,形成促炎、抗炎等不同功能亚型,调控免疫平衡。
巨噬细胞最显著的生物学特征是功能可塑性,即在外源性信号(如细胞因子、病原体相关分子模式等)刺激下,分化为具有特定表型和功能的亚型,这一过程被称为巨噬细胞极化。
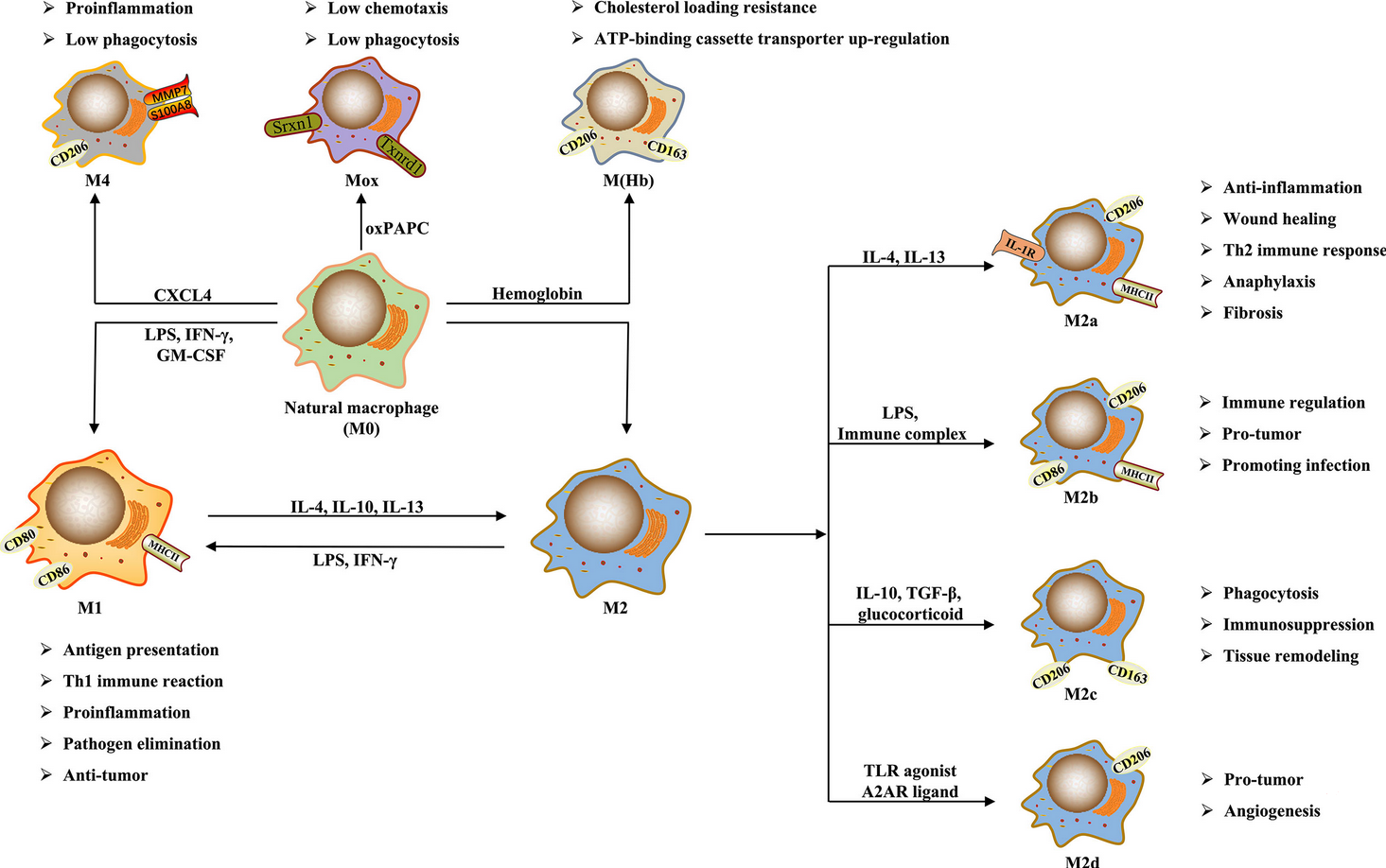
图1. 巨噬细胞的极化(DOI:10.3389/fimmu.2021.803037)
极化是巨噬细胞适应微环境变化的关键方式:在感染、炎症等病理状态下,巨噬细胞可向促炎表型转化,清除病原体并启动免疫应答;而在组织损伤修复、免疫稳态维持过程中,则偏向抗炎表型,抑制过度炎症反应并促进组织愈合。值得注意的是,巨噬细胞极化并非不可逆的单向过程,其表型可随微环境信号改变而动态转换,体现了免疫调节的灵活性。
基于功能表型和诱导信号的差异,巨噬细胞极化的经典分类为M1型(经典激活型)和M2型(替代激活型),该二分法虽简化了体内复杂的表型谱,但为实验研究提供了清晰的功能划分框架。
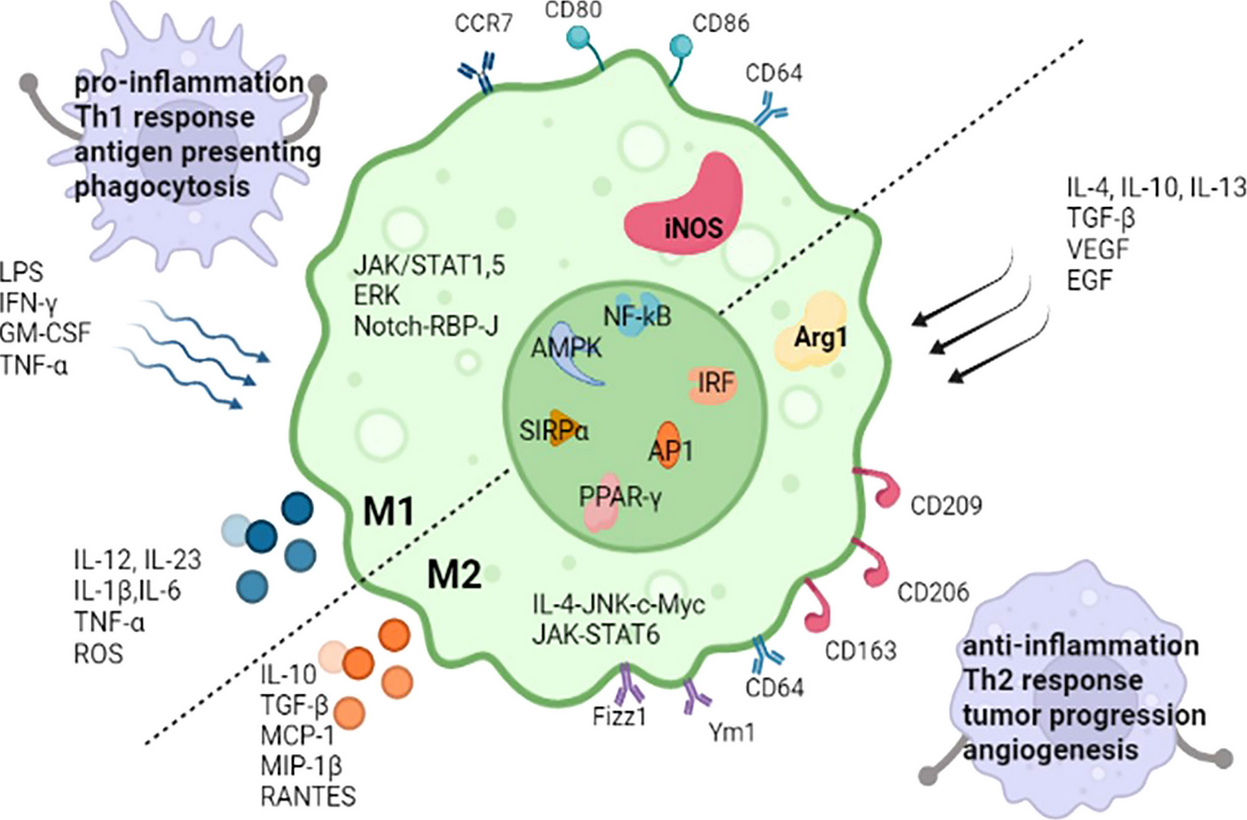
图2. M1和M2巨噬细胞(DOI:10.3389/fimmu.2022.880286)
M1型巨噬细胞主要由干扰素-γ(IFNγ)单独或联合脂多糖(LPS)、肿瘤坏死因子(TNF)等信号诱导激活。其核心功能是启动和放大炎症反应,通过分泌大量促炎因子和抗菌分子,发挥抗微生物、抗肿瘤作用。
关键标志物包括:
mRNA水平:趋化因子(CXCL9、CXCL10)、细胞因子(TNF、IL-1β、IL-12)、酶类(IDO1,色氨酸分解代谢酶);
表面蛋白:MHCⅡ类分子(如人类HLA-DR)、共刺激分子(CD86)、Fc受体(CD64);
分泌型细胞因子:TNF、IL-1β、IL-6、IL-12、IL-23等。
需注意人与小鼠M1标志物的物种差异:小鼠M1巨噬细胞高表达诱导型一氧化氮合酶(iNOS),而人类M1巨噬细胞中无此标志物,这也是临床转化研究中需重点关注的问题。
M2型巨噬细胞是功能异质性极强的群体,根据诱导信号和功能差异可进一步分为M2a、M2b、M2c、M2d四个亚型,其核心功能为抗炎、免疫调节、组织修复及血管生成。各亚型关键特征如下:
与M1类似,M2亚型也存在物种特异性:小鼠M2a巨噬细胞高表达Arg1、Ym1、Fizz1等基因,但这些基因在人类中无同源物,因此在选择检测标志物时需严格区分物种来源。
极化实验是巨噬细胞研究的“核心工具”,其价值本质是通过“人为调控表型”,破解巨噬细胞在生理病理中的作用,具体可分为三大场景:
机制解析:比如肿瘤微环境中,M2型巨噬细胞如何促进癌细胞转移?通过体外极化获取纯M2表型细胞,即可深入研究其分泌因子、信号通路的作用;
药物研发:某款免疫治疗药物能否“逆转”肿瘤相关巨噬细胞的M2表型?实验中加入药物后,观察M1标志物是否上调即可快速验证;
功能验证:极化后的巨噬细胞是否具备预期功能?比如M1型是否能高效吞噬细菌,M2型是否能促进成纤维细胞增殖,均需通过极化实验获取细胞后验证。
明确实验目的,才能精准选择细胞模型和检测方法——比如研究人类疾病,优先选THP-1(人源);研究小鼠体内机制,BMDM(原代细胞)更贴近生理状态。
科研中常用THP-1(人源细胞系)、RAW264.7(小鼠细胞系)、BMDM(小鼠原代巨噬细胞)开展极化实验,三者因来源和特性不同,极化方案存在显著差异,具体参数如下表:
实验成功的关键在“细节质控”,以下从细胞、试剂、操作三个维度梳理关键要点,覆盖新手易犯错误:
状态优先:仅用“对数生长期”细胞——THP-1呈悬浮球状、无聚集;RAW264.7形态饱满、贴壁均匀;BMDM呈梭形或多角形,活力需≥95%(台盼蓝染色验证),衰老或凋亡细胞会“抵抗”极化信号;
密度精准:THP-1分化前接种密度5×10⁵ cells/mL,RAW264.7和BMDM极化接种密度6×10⁵ cells/mL,密度过高易缺氧、过低极化信号不足,均会导致结果偏差;
原代细胞特殊护理:BMDM培养过程中避免频繁换液,M-CSF诱导第4天补加半量培养基,保持细胞因子浓度稳定。
刺激剂质控:LPS、细胞因子(IFNγ/IL-4等)需分装成10μL小份,-80℃冻存,避免反复冻融(≤3次),使用前室温平衡30分钟;浓度需严格校准,比如LPS浓度偏差10ng/mL就会导致M1极化效率波动20%以上;
培养基适配:THP-1用RPMI 1640培养基,RAW264.7和BMDM用DMEM培养基,均需添加10%胎牛血清(选低内毒素批次,避免干扰LPS刺激)和1%双抗;
标志物试剂匹配:检测时需区分物种——人源THP-1用抗人CD86/CD206抗体,小鼠细胞用抗小鼠对应抗体,交叉使用会导致假阴性。
分组规范:必设“空白对照组(M0,不加刺激剂)”和“阳性对照组”,每组至少3个复孔,减少操作误差;药物干预实验需额外设“药物溶剂对照组”(如DMSO对照组),排除溶剂对极化的影响;
污染防控:全程无菌操作,加样枪头、培养板均用无菌耗材,一旦发现培养基浑浊或细胞出现异常颗粒,立即丢弃,污染会彻底破坏巨噬细胞表型;
时间统一:同一批实验的刺激、收集、检测时间需严格同步,比如所有孔均刺激24h后同时收集样本,避免因时间差导致的标志物表达差异。
以上注意事项需结合细胞特性灵活调整,比如THP-1预分化后需用PBS洗2次去除残留PMA,而RAW264.7直接换液即可,后续检测需匹配各细胞的特异性标志物,确保结果可靠。
(M-CSF)(GM-CSF)(TNF‐α)(IL-4)(IL-6)(IL‐10)(IL-13)
(CD11b)(CD11c)(CD14)(CD15)(CD16)(CD80)(CD86)(CD163)(CD204)(CD206)(CD209)(CD274)(F4/80)(HLA-DR)(Ly6G)(MHC-Ⅱ)(IFN-γ)(IL-1)(IL-6)(IL-12)(TNF-α)(TGF-β)(Arg-1)(iNOS)
标志物
反应性
名称
应用
货号
IL-1
Human, Cercocebus atys, Macaca fascicularis, etc
Anti-IL1B/IL1F2 Polyclonal Antibody
ELISA, IHC, WB
abinScience提供一系列巨噬细胞极化相关的抗体和重组蛋白,广泛应用于ELISA、Western Blot、免疫组化、FCM等实验,帮助科研人员深入研究巨噬细胞的极化。更多巨噬细胞相关产品请扫码咨询或访问abinScience官网:www.abinscience.cn。
发邮件给我们:support@abinscience.com
参考文献
[1] Zhang J, Muri J, Fitzgerald G, Gorski T, Gianni-Barrera R, Masschelein E, D'Hulst G, Gilardoni P, Turiel G, Fan Z, Wang T, Planque M, Carmeliet P, Pellerin L, Wolfrum C, Fendt SM, Banfi A, Stockmann C, Soro-Arnáiz I, Kopf M, De Bock K. Endothelial Lactate Controls Muscle Regeneration from Ischemia by Inducing M2-like Macrophage Polarization. Cell Metab. 2020 Jun 2;31(6):1136-1153.e7.
[2]
Zhou W, Hu G, He J, Wang T, Zuo Y, Cao Y, Zheng Q, Tu J, Ma J, Cai R,
Chen Y, Fan Q, Dong B, Tan H, Wang Q, Xue W, Cheng J. SENP1-Sirt3
signaling promotes α-ketoglutarate production during M2 macrophage
polarization. Cell Rep. 2022 Apr 12;39(2):110660.
[3]
Bai X, Guo YR, Zhao ZM, Li XY, Dai DQ, Zhang JK, Li YS, Zhang CD.
Macrophage polarization in cancer and beyond: from inflammatory
signaling pathways to potential therapeutic strategies. Cancer Lett.
2025 Aug 10;625:217772.
[4]
Ghafouri-Fard S, Abak A, Tavakkoli Avval S, Shoorei H, Taheri M,
Samadian M. The impact of non-coding RNAs on macrophage polarization.
Biomed Pharmacother. 2021 Oct;142:112112.
[5]
Mohapatra S, Pioppini C, Ozpolat B, Calin GA. Non-coding RNAs
regulation of macrophage polarization in cancer. Mol Cancer. 2021 Feb
1;20(1):24.
[6]
Díaz-Bulnes P, Saiz ML, López-Larrea C, Rodríguez RM. Crosstalk Between
Hypoxia and ER Stress Response: A Key Regulator of Macrophage
Polarization. Front Immunol. 2020 Jan 8;10:2951.
[7]
Sun JX, Xu XH, Jin L. Effects of Metabolism on Macrophage Polarization
Under Different Disease Backgrounds. Front Immunol. 2022 Jul
14;13:880286.
相关新闻资讯