
6YR企业会员
发布人:广州优南科技有限公司
发布日期:2025/1/14 15:51:49
编者按:2024年,美国食品药品监督管理局(FDA)药物评估与研究中心(CDER)批准了50种新药(包括小分子药物、生物制剂和寡核苷酸治疗药物)。虽然这一数字略低于2023年的55种,但仍然是是过去30年中批准数量第二多的一年。
2024年,CDER批准了50种新药,其中24种(48%)为同类首创药物(First-in-Class)。这些药物在治疗特定疾病方面展现出了新的药理作用,如Anktiva(nogapendekin alfa inbakicept-pmln)用于治疗对卡介苗无反应的非肌层浸润性膀胱癌,Cobenfy(xanomeline and trospium chloride)成为首个治疗成人精神分裂症的毒蕈碱类药物,Lumisight(pegulicianine)助力乳腺癌的术中癌组织检测等。
罕见病患者通常面临治疗选择有限或无药可用的窘境。2024年,CDER批准的50种新药中有26种(52%)用于治疗罕见病,包括针对尼曼-皮克病C型的Aqneursa(levacetylleucine)、用于治疗6岁及以上杜氏肌营养不良症的Duvyzat(givinostat)以及治疗原发性胆汁性胆管炎的Iqirvo(elafibranor)等。
在抗感染领域,2024年获批的新药也为临床治疗提供了有力支持:
Exblifep(头孢吡肟,enmetazobactam):用于治疗由以下敏感病原体引起的18岁及以上患者的复杂性尿路感染(包括肾盂肾炎):大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、奇异变形杆菌和阴沟肠杆菌复合体。
Zevtera(头孢比罗酯钠):用于治疗成人金黄色葡萄球菌血流感染(菌血症)、急性细菌性皮肤和皮肤结构感染,以及成人和儿童(3个月至18岁以下)的社区获得性细菌性肺炎。
Orlynvah(硫培南乙羟氨苄,丙磺舒):用于治疗由特定微生物(大肠埃希菌、肺炎克雷伯菌或奇异变形杆菌)引起的非复杂性尿路感染,适用于口服抗菌药治疗方案有限或无其他替代治疗方案的成年女性患者。
表1. CDER 2024年获批新药
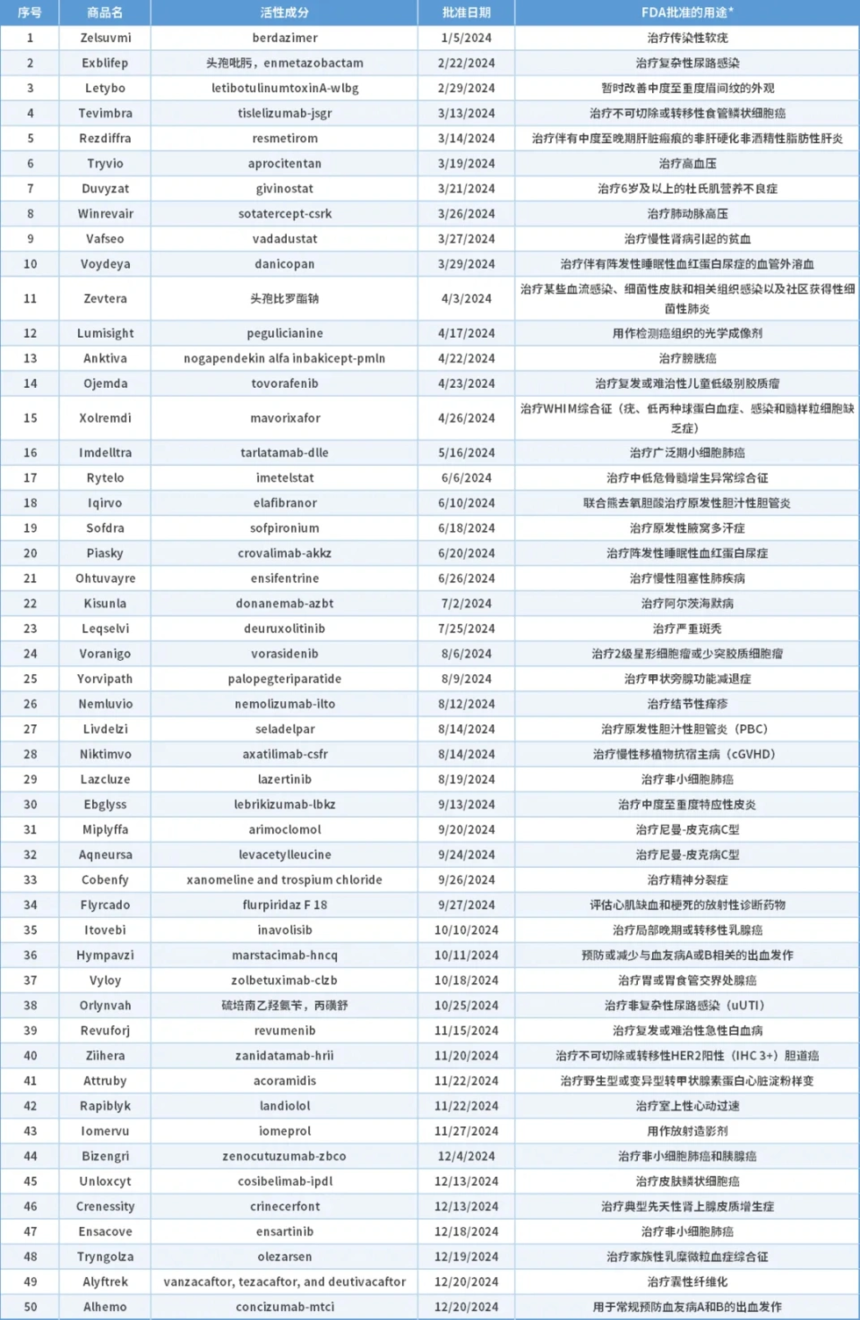
*“FDA批准的用途”仅供介绍。如需了解FDA批准的每种产品的使用条件(如适应证、适用人群、给药方案),请参阅最新的获批处方信息。
转载链接:https://news.qq.com/rain/a/20250113A09BPL00
如有侵权请联系我们,我们将会删除。
相关新闻资讯