
4YR企业会员
发布人:上海优宁维生物科技股份有限公司
发布日期:2024/12/12 9:25:03
简介
30年前,研究人员在土壤变形虫盘状变形虫中首次观察到,细胞皮层中的肌动蛋白结构可以形成动态的波浪状图案1,2。随后,越来越多的其他类型的细胞中也发现了肌动蛋白波,包括中性粒细胞、树突状细胞、T 细胞、神经元、内皮细胞、成纤维细胞和角膜细胞1,3,4。
虽然肌动蛋白波在形态、传播速度和生化成分上存在很大差异3(图1),但它们可以被广泛地定义为“在肌动蛋白皮层中以波状方式传播的丝状肌动蛋白密度增加的微米级细胞骨架区域”1。早期的许多研究工作都在探讨肌动蛋白在细胞迁移和分裂中的作用1,但现在人们发现了肌动蛋白更广泛的功能作用。本文我们将回顾自最初发现肌动蛋白波以来,我们对肌动蛋白波的认识是如何发展的,并重点介绍近期的重要发现,这些发现表明肌动蛋白波在多细胞范围内发挥着重要的生物学作用。
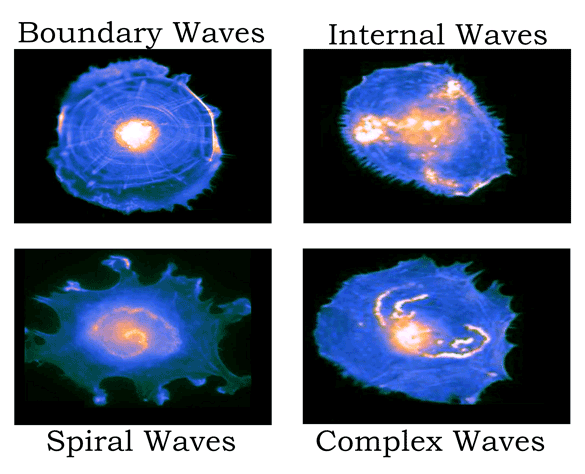
图1:在培养的人主动脉内皮细胞中观察到的不同肌动蛋白波型的示意图(Riedl M. et al Nat Commun. 2023; ref. 4)
1.肌动蛋白波的自发产生
早期的一个关键问题涉及肌动蛋白波的起源,通过应用其它波动现象的理论原理,证明了细胞肌动蛋白皮层具有可激发介质的特性5-7。这些系统能够自发产生波,就细胞皮层而言,系统的调节(即激活阈值)取决于肌动蛋白核聚体的时空分布和F-肌动蛋白组装速率之间的平衡。当局部核聚体浓度超过一定阈值时,就会产生肌动蛋白波8。F-肌动蛋白和肌动蛋白核聚体之间的负反馈完成了典型的应激系统的激活-抑制动力学7,9。因此,产生和传播肌动蛋白波的能力是肌动蛋白皮层作为“主动适应材料”的固有特征10。
2.肌动蛋白波引导细胞运动
在自适应可激发介质中,外部扰动可以引起波的形成。早期的一个重要发现是纤毛膜中由压力诱导的后向肌动蛋白波,这种波将α-肌动蛋白和MYLK信号复合物从纤毛膜顶端输送到基部,以控制收缩/伸展周期11。还有研究表明,波形调节复合体在中性粒细胞HL-60中产生的肌动蛋白波,实验观察与理论研究中发展的自激活和延迟抑制(由于F-肌动蛋白的缓慢扩散)模型一致12,作者认为细胞趋化运动依赖于多个肌动蛋白波的共同作用。
有研究者提出,自发的肌动蛋白波动力学可以解释阿米巴样细胞的随机行走6,7,这一点在树突状细胞中得到了很好的证明9。树突状细胞在巡视组织寻找病原体时表现出随机行走行为,将它的运动轨迹绘制出来,并可根据其固有的肌动蛋白波动力学建模,说明了这些细胞如何通过调节肌动蛋白核聚体的分布和肌动蛋白聚合速率来自适应地控制其迁移模式。众所周知,Arp2/3复合体和Ena/VASP肌动蛋白核聚体对树突状细胞的正常运动非常重要9,13。
3.调节肌动蛋白动力学的其他应激网络
对肌动蛋白波的研究也揭示了相关信号分子的脉冲行为,这些分子表现出应激的动力学10,14。例如,在卵母细胞和胚胎细胞中进行细胞分裂时,Rho 活性波在肌动蛋白波之前传播15。小GTP酶(如RhoA)由于其活性的自催化传播,可以充当应激的快速扩散激活剂16。与肌动蛋白波类似,延迟来自 F-肌动蛋白介导的对波后对 Rho 活性抑制的负反馈,从而导致观察到波动模式15。因此,应激的激活-抑制特性对Rho活性影响也是明显的。
在线虫胚胎中可以观察到一种相关的机制,其中延迟的负反馈来自两个Rho GAP(RGA-3/4),它们被F-肌动蛋白招募以消除前导Rho波后的小GTP酶活性10,17。其他研究结果表明,Ras活性进一步微调了肌动蛋白波的动力学,相对较小的变化就足以引起波的大小、速度和射速的巨大变化18。
综上所述,研究人员提出了一个新概念——独特的信号转导应激网络(STEN),它可以感知化学信息,与细胞骨架应激网络(CEN)对物理线索的感知类似,CEN完全依赖于肌球蛋白皮层作为应激的固有属性14。在接触类胶原纳米脊的细胞中,STEN和CEN衍生的波被限制在不同的区域,CEN波更有可能直接沿着脊线发起19。因此,STEN和CEN应激系统之间的串扰被认为是整合不同环境信号以正确引导细胞迁移的关键。
4.肌动蛋白波的新功能
为了支持上述观点,已证实 CEN 和 STEN 系统都能感知电场。值得注意的是,皮肤伤口会迅速激发强大的生物电场,在伤口修复过程中提供重要的细胞引导信号20,并随着伤口的愈合过程而逐渐减弱21。细胞在电场中的定向迁移是再生和发育以及伤口愈合中的一个重要现象22。
在盘状芽孢杆菌细胞中,可以看到电场极化肌动蛋白波核并引导波的传播,从而介导趋电性22。虽然这些电场在全局范围内引导肌动蛋白波,但即使改变场的方向,纳米脊仍能诱导局部的肌动蛋白波(通过 CEN 系统)跟随脊,这意味着可应激系统的局部和全局调节都以互补的方式发挥作用,可以通过肌动蛋白动力学的变化来解释多个指导信号的转导23。
实际上,肌动蛋白丝作为“生物电线”的特性早在30年前就已被发现了24,而且已经证实肌动蛋白丝会根据电场定向排列25。由于内源性生物电网络正逐渐成为细胞发育和再生过程中模式控制的一个自主层26,生物电引导的肌动蛋白波似乎有可能在形态发生(包括伤口修复)过程中作为细胞组织的基础,以响应支配生物模式形成的电信号。
另一方面,众所周知,即使在常氧条件下,癌细胞也会上调糖酵解(称为沃伯格效应)。新的研究结果显示,糖酵解酶被募集到细胞皮层,并与肌动蛋白波共定位27,这表明癌细胞可以利用糖酵解快速产生局部 ATP,从而皮层产生的直接能量驱动迁移28。虽然之前的研究已将糖酵解作为癌细胞运动的一种能量来源29,30,但糖酵解与肌动蛋白波的功能性关联为沃伯格效应提供了新的机理认识。与未转化的细胞相比,癌细胞表现出更高的糖酵解和肌动蛋白波活性,并且随着转移指数的增加而逐渐增强27。
5.新的发展和展望
在最近的一项研究中,发现了细胞群中肌动蛋白波的同步性和集体运动4。与在其他细胞类型中观察到的一致,人主动脉内皮细胞中肌动蛋白波的成核频率与迁移速度相关,但与离体的细胞在低密度下的运动方式不同。在细胞汇合时,可观察到连贯的集体运动,这可能与肌动蛋白波的成核频率同步有关。作者将此称为“频率锁定”,以实现有序的集体运动,推导出相关的耦合机制将是未来研究的一个引人入胜的方向。
参考文献:
【1】Beta C, Edelstein-Keshet L, Gov N, Yochelis A. From actin waves to mechanism and back: How theory aids biological understanding. Elife. 2023;12:e87181. https://doi.org/10.7554/eLife.87181
【2】Vicker MG, Xiang W, Plath PJ, Wosniok W. Pseudopodium extension and amoeboid locomotion in Dictyostelium discoideum: Possible autowave behaviour of F-actin. Physica D. 1997;101(3–4):317–332. https://doi.org/10.1016/S0167-2789(96)00224-2
【3】Beta C, Gov NS, Yochelis A. Why a large-scale mode can be essential for understanding intracellular actin waves. Cells. 2020;9(6):1533. https://doi.org/10.3390/cells9061533
【4】Riedl M, Mayer I, Merrin J, Sixt M, Hof B. Synchronization in collectively moving inanimate and living active matter. Nat Commun. 2023;14(1):5633. https://doi.org/10.1038/s41467-023-41432-1
【5】Doubrovinski K, Kruse K. Cytoskeletal waves in the absence of molecular motors. Europhys Lett. 2008;83(1):18003. https://doi.org/10.1209/0295-5075/83/18003
【6】Doubrovinski K, Kruse K. Cell motility resulting from spontaneous polymerization waves. Phys Rev Lett. 2011;107(25):258103. https://doi.org/10.1103/PhysRevLett.107.258103
【7】Ecker N, Kruse K. Excitable actin dynamics and amoeboid cell migration. PLoS One. 2021;16(2):e0246311. https://doi.org/10.1371/journal.pone.0246311
【8】Motoike IN, Adamatzky A. Three-valued logic gates in reaction–diffusion excitable media. Chaos Solitons Fractals. 2005;24(1):107–114. https://doi.org/10.1016/j.chaos.2004.07.021
【9】Stankevicins L, Ecker N, Terriac E, et al. Deterministic actin waves as generators of cell polarization cues. Proc Natl Acad Sci U S A. 2020;117(2):826–835. https://doi.org/10.1073/pnas.1907845117
【10】Staddon MF, Munro EM, Banerjee S. Pulsatile contractions and pattern formation in excitable actomyosin cortex. PLoS Comput Biol. 2022;18(3):e1009981. https://doi.org/10.1371/journal.pcbi.1009981
【11】Giannone G, Dubin-Thaler BJ, Döbereiner H-G, Kieffer N, Bresnick AR, Sheetz MP. Periodic lamellipodial contractions correlate with rearward actin waves. Cell. 2004;116(3):431–443. https://doi.org/10.1016/s0092-8674(04)00058-3
【12】Weiner OD, Marganski WA, Wu LF, Altschuler SJ, Kirschner MW. An actin-based wave generator organizes cell motility. PLoS Biol. 2007;5(9):e221. https://doi.org/10.1371/journal.pbio.0050221
【13】Visweshwaran SP, Nayab H, Hoffmann L, Gil M, Liu F, Kühne R, Maritzen T. Ena/VASP proteins at the crossroads of actin nucleation pathways in dendritic cell migration. Front Cell Dev Biol. 2022;10:1008898. https://doi.org/10.3389/fcell.2022.1008898
【14】Miao Y, Bhattacharya S, Banerjee T, et al. Wave patterns organize cellular protrusions and control cortical dynamics. Mol Syst Biol. 2019;15(3):e8585. https://doi.org/10.15252/msb.20188585
【15】Bement WM, Leda M, Moe AM, et al. Activator–inhibitor coupling between Rho signalling and actin assembly makes the cell cortex an excitable medium. Nat Cell Biol. 2015;17(11):1471–1483. https://doi.org/10.1038/ncb3251
【16】Tsyganov MA, Kolch W, Kholodenko BN. The topology design principles that determine the spatiotemporal dynamics of G-protein cascades. Mol Biosyst. 2012;8(3):730–743. https://doi.org/10.1039/c2mb05375f
【17】Michaux JB, Robin FB, McFadden WM, Munro EM. Excitable RhoA dynamics drive pulsed contractions in the early C. elegans embryo. J Cell Biol. 2018;217(12):4230–4252. https://doi.org/10.1083/jcb.201806161
【18】Lin Y, Pal DS, Banerjee P, et al. Ras-mediated homeostatic control of front–back signaling dictates cell polarity. bioRxiv. Preprint posted online September 1, 2023. https://doi.org/10.1101/2023.08.30.555648
【19】Yang Q, Miao Y, Banerjee P, et al. Nanotopography modulates intracellular excitable systems through cytoskeleton actuation. Proc Natl Acad Sci U S A. 2023;120(19):e2218906120. https://doi.org/10.1073/pnas.2218906120
【20】Tai G, Tai M, Zhao M. Electrically stimulated cell migration and its contribution to wound healing. Burns Trauma. 2018;6:20. https://doi.org/10.1186/s41038-018-0123-2
【21】Nuccitelli R, Nuccitelli P, Ramlatchan S, Sanger R, Smith PJS. Imaging the electric field associated with mouse and human skin wounds. Wound Repair Regen. 2008;16(3):432–441. https://doi.org/10.1111/j.1524-475x.2008.00389.x
【22】Yang Q, Miao Y, Campanello LJ, et al. Cortical waves mediate the cellular response to electric fields. Elife. 2022;11:e73198. https://doi.org/10.7554/eLife.73198
【23】Bull AL, Campanello L, Hourwitz MJ, Yang Q, Zhao M, Fourkas JT, Losert W. Actin dynamics as a multiscale integrator of cellular guidance cues. Front Cell Dev Biol. 2022;10:873567. https://doi.org/10.3389/fcell.2022.873567
【24】Lin EC, Cantiello HF. A novel method to study the electrodynamic behavior of actin filaments. Evidence for cable-like properties of actin. Biophys J. 1993;65(4):1371–1378. https://doi.org/10.1016/S0006-3495(93)81188-3
【25】Arsenault ME, Zhao H, Purohit PK, Goldman YE, Bau HH. Confinement and manipulation of actin filaments by electric fields. Biophys J. 2007;93(8):L42–L44. https://doi.org/10.1529/biophysj.107.114538
【26】Levin M. Endogenous bioelectrical networks store non-genetic patterning information during development and regeneration. J Physiol. 2014;592(11):2295–2305. https://doi.org/10.1113/jphysiol.2014.271940
【27】Zhan HD, Borleis J, Janetopoulos C, Devreotes P. Abstract 288: Glycolysis is enriched to propagating waves in cell cortex as a new mechanism for cancer progression. Cancer Res. 2023;83(7_Suppl):288. https://doi.org/10.1158/1538-7445.am2023-288
【28】Zheng J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation. Oncol Lett. 2012;4(6):1151–1157. https://doi.org/10.3892/ol.2012.928
【29】Shiraishi T, Verdone JE, Huang J, et al. Glycolysis is the primary bioenergetic pathway for cell motility and cytoskeletal remodeling in human prostate and breast cancer cells. Oncotarget. 2015;6(1):130–143. https://doi.org/10.18632/oncotarget.2766
【30】Zanotelli MR, Zhang J, Reinhart-King CA. Mechanoresponsive metabolism in cancer cell migration and metastasis. Cell Metab. 2021;33(7):1307–1321. https://doi.org/10.1016/j.cmet.2021.04.002
部分相关产品推荐:
未标记的肌动蛋白
肌动蛋白生化试剂盒
关于Cytoskeleton
Cytoskeleton作为专业的细胞骨架和小G蛋白相关产品的生物科技公司,可以提供专业且高度可靠的Pulldown和GLISA检测试剂盒,在过去的20年里,无数各个领域的研究人员已经利用Cytoskeleton的产品产出许多优秀的实验成果。
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!


相关新闻资讯