
3YR企业会员
发布人:武汉佰乐博生物技术有限公司
发布日期:2024/11/8 10:19:09
在癌症治疗领域,肿瘤免疫微环境(TIME)的研究正逐渐揭开其神秘面纱。佰乐博生物代理的AntibodySystem流式抗体,以其高特异性和低背景信号,为TIME的研究提供了强有力的工具。最新Cell文章介绍了一种新技术——基于T-Linker的多模态靶向嵌合体(Multi-TACs),这项技术能够将多种治疗模块整合到单一分子中,为癌症免疫治疗带来了新的突破。流式抗体的应用,使得研究者能够精确检测树突状细胞表面的肿瘤抗原复合物,从而深入理解TIME中的细胞相互作用,为未来免疫治疗策略提供了新的视角。
文献解读
在人类与癌症的持久战中,免疫疗法无疑是近年来最闪亮的一颗星,凭借其独特机制为许多患者带来了长期生存的可能性。然而,面对复杂的肿瘤免疫微环境(Tumor Immune Microenvironment, TIME),即便是最具突破性的治疗方法也遭遇瓶颈。TIME是由多元化的免疫细胞网络构成的生态体系,既可能是抵抗肿瘤的前线战士,又常常扮演着阻碍免疫攻击的角色,其复杂性直接影响了免疫疗法的有效性和持久力。肿瘤内存在各种免疫抑制因子,如PD-L1、CTLA-4等检查点分子,它们能抑制T细胞活性,保护肿瘤免受免疫系统攻击。肿瘤细胞通过改变代谢途径,如乳酸积累、营养竞争等方式,影响免疫细胞功能,导致免疫抑制环境形成。
针对上述挑战,研究者们正在探索一系列新型方法,旨在重塑TIME,增强免疫疗法的效果,如免疫检查点抑制剂,靶向PD-1/PD-L1、CTLA-4等,解除免疫抑制,恢复T细胞功能,或疫苗疗法、CAR-T细胞疗法,以及联合疗法,结合不同机制药物,协同作用克服单一疗法局限性。
传统免疫疗法虽有效,却受限于其广义性,缺乏针对性。药物联用虽尝试协同增效,却易陷于毒性与效率失衡困境。双/多特异性抗体虽具优势,仍面临功能局限与灵活性不足的问题。构想一个场景:若能将免疫武器比作乐高积木,每个组件拥有独立功能,又能自由组合,岂非梦寐以求之策?
Fig.1 文章摘要图
11月5号,Cell最新出炉的文章构建了一种基于三重正交连接子(T-Linker)的可编程平台,该平台能够将多种治疗模块整合到单一的多模态靶向嵌合体(Multi-TACs)中,以实现在肿瘤-免疫微环境(TIME)中对不同免疫细胞的靶向共激活。在体外细胞以及动物模型实验中,Multi-TAC对多种实体瘤都取得了出色的疗效。陈鹏教授与北京大学席建忠教授、中国医学科学院肿瘤医院康晓征教授、南京大学李颜教授、北京大学第三医院林坚研究员为论文共同通讯作者。这一创新策略有望为癌症免疫治疗带来革命性的进展。
简单来说,文章中介绍的T-Linker技术是一种创新的化学工具,它能够将三种不同的治疗模块(如肿瘤靶向分子、免疫细胞共激活分子等)精确地整合到一个单一的多模态靶向嵌合体(Multi-TACs)中。生物正交反应使得科学家们可以在活体细胞内通过化学反应标记、操控生物分子,并且不会干扰原有的生物化学过程。这些反应的组合使得T-Linker能够高效且选择性地将不同的治疗分子连接在一起,形成具有多重功能的Multi-TACs。
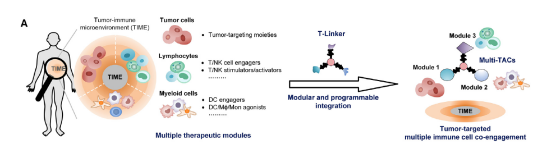
Fig.2 The T-Linker technology enables modular and programmable integration of multiple therapeutic modules into single agents, termed Multi-TACs, which support multiple immune cell co-engagement in TIME
研究者们设计了多种Multi-TACs,其中包括EGFR-CD3-PDL1 Multi-TAC,它能够同时靶向肿瘤细胞上的EGFR、T细胞上的CD3以及树突状细胞上的PDL1。这种Multi-TAC通过物理方式将T细胞和树突状细胞共激活,从而在肿瘤微环境中增强了抗肿瘤免疫反应。
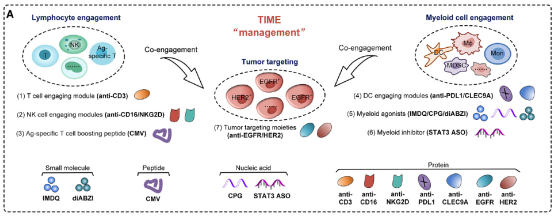
Fig.3 Therapeutic modules for Multi-TAC construction
研究者们在体外实验中验证了包括T-Linker技术的体外毒性,来确定T-Linker的生物相容性;Multi-TACs的构建和表征,对其进行了质谱(MS)和SDS-PAGE分析,以验证其结构和稳定性;EGFR-CD3-PDL1 Multi-TAC的体外功能评估,在A549肿瘤细胞、T细胞和树突状细胞的共培养体系中评估了EGFR-CD3-PDL1 Multi-TAC的T细胞激活能力、细胞因子分泌以及直接杀伤肿瘤细胞的效果。
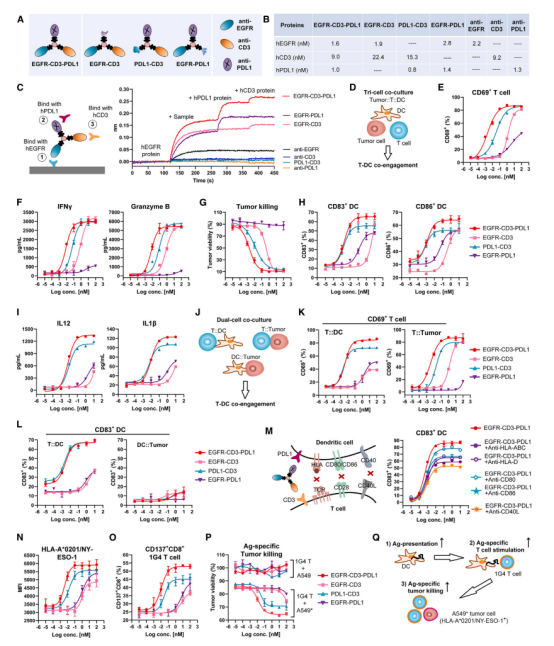
Fig.4 The EGFR-CD3-PDL1 Multi-TAC enables tumor-targeted T cells and DCs co-engagement
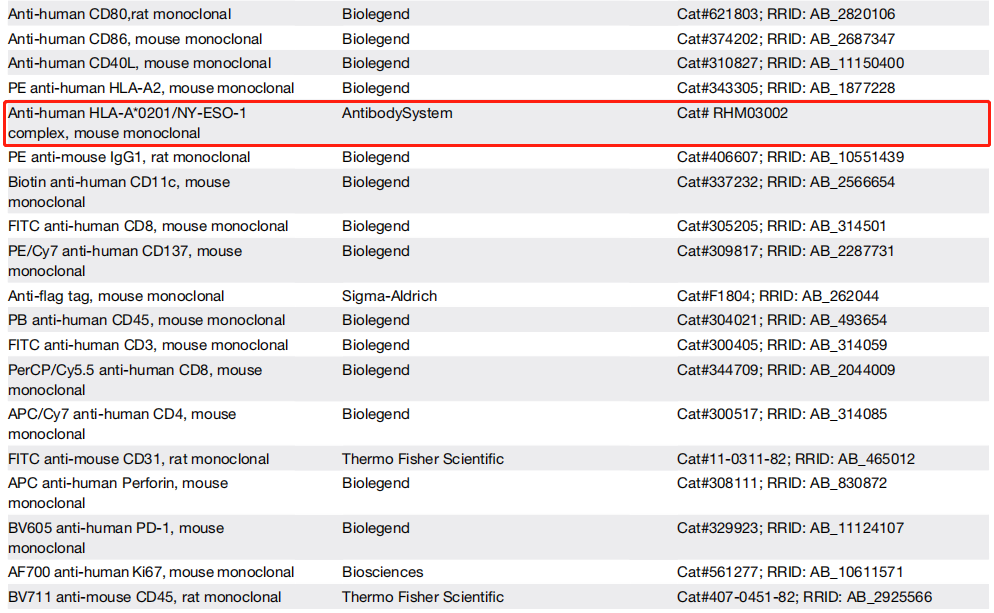
NY-ESO-1是一种肿瘤抗原,而HLA-A0201是一种人类白细胞抗原(HLA)。通过检测HLA-A*0201/NY-ESO-1复合物,研究者们可以评估DCs是否有效地将肿瘤抗原呈递给T细胞,这是启动特异性抗肿瘤免疫反应的关键步骤。通过流式细胞术分析,研究者们能够定量DCs表面HLA-A0201/NY-ESO-1复合物的水平,观察到HLA-A0201/NY-ESO-1复合物在DCs表面的表达增加。这表明EGFR-CD3-PDL1 Multi-TAC不仅能够激活T细胞和DCs,还能够促进DCs对肿瘤抗原的有效呈递。
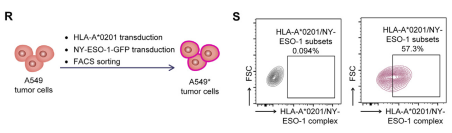
Fig.5 Isolated A549* cells were stained with antibodies specific for the HLA-A*0201/NY-ESO-1 complex and evaluated by flow cytometry
综上所有结果显示,EGFR-CD3-PDL1 Multi-TAC能够显著激活T细胞和树突状细胞,并促进了肿瘤抗原的呈递和特异性T细胞的激活。
研究人员评估了体内的情况,包括药物耐受性评估,在C57BL/6小鼠中评估了不同剂量EGFR-CD3-PDL1 Multi-TAC的耐受性,通过连续注射8次不同剂量的Multi-TAC,监测小鼠体重变化和主要器官的组织病理学变化。以及药代动力学研究,通过构建带有Flag标签的EGFR-CD3-PDL1 Multi-TAC(EGFR-Flag-CD3-PDL1),在C57BL/6小鼠中评估了Multi-TAC的药代动力学特性,包括血清中Multi-TAC的稳定性和半衰期。
同时,在不同的人源化小鼠模型中评估了Multi-TACs的疗效,包括PBMC人源化小鼠模型(PBMC Humanized Mice Model)、HSC人源化小鼠模型(HSC Humanized Mice Model)、转基因人源化小鼠模型(Transgenic Humanized Mice Model)、患者来源肿瘤样细胞团(PTC)模型。
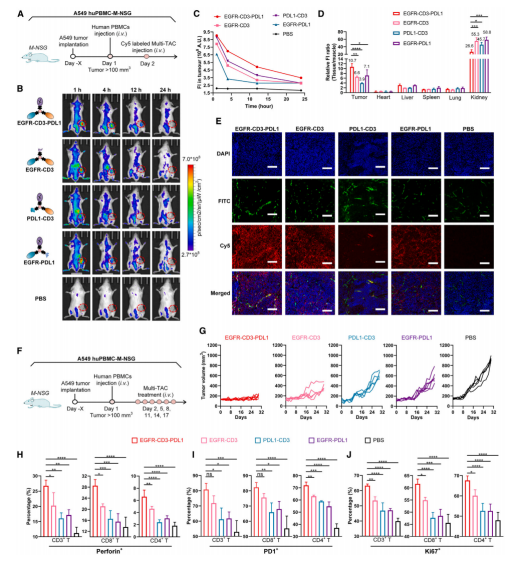
Fig.6 In vivo tumor targeting and antitumor efficacy of the EGFR-CD3-PDL1 Multi-TAC in PBMC humanized mice
在体内实验的结果表明,这些Multi-TACs在抑制肿瘤生长和促进免疫细胞浸润方面表现出了显著的效果。
在本文中,佰乐博生物独家代理的AntibodySystem提供的流式抗体在评估EGFR-CD3-PDL1 Multi-TAC激活的树突状细胞(DCs)功能的研究中,通过使用针对HLA-A*0201/NY-ESO-1复合物的特异性抗体(Cat# RHM03002),研究者们能够精确地检测DCs表面呈现的肿瘤抗原复合物,这对于理解DCs在肿瘤微环境中的抗原呈递能力至关重要。AntibodySystem提供的流式抗体因其高特异性和低背景信号,为本文中的实验提供了可靠的数据支持。
更多相关资讯见佰乐博官方网站
产品咨询及其他技术咨询请发送邮至:
products@biolabreagent.com
关于我们
AntibodySystem
AntibodySystem SAS由具有30多年蛋白抗体开发经验的专家创立于法国,专注于生命科学和生物制药领域研究,总部位于法国斯特拉斯堡市。AntibodySystem自主开发高效、高产的真核重组表达系统,利用该系统生产高质量的重组蛋白、抗体产品。目前产品管线覆盖各种病毒研究蛋白/抗体质控品、in vivo功能性抗体、流式抗体、抗药药物靶点蛋白以及其他活性蛋白、PEG抗体、磷酸化抗体、抗DNA/RNA抗体、特殊小分子抗体、生物类似物、RUO ELISA试剂盒。

佰乐博生物
武汉佰乐博生物(Biolab Reagents)由五位毕业于华中科技大学,华中农业大学,武汉大学等知名高校,且具有二十年工作经验的生命科学领域顶级研究者创立于2021年,凭借丰富的产品开发经验,利用全球领先的技术平台,引进和整合全球高品质的蛋白、抗体和试剂盒产品。目前,佰乐博生物作为法国AntibodySystem和ProteoGenix在亚洲的独家总代理,提供近30,000种生命科学试剂,核心产品涵盖蛋白、抗体和试剂盒,旨在为科研工作者提供专业、全面、可靠的试剂支持,推动生命科学研究的深入发展。
相关新闻资讯