-
外観
無色澄明の液体
-
種類
次亜リン酸は、工業用薬品や研究開発用試薬製品として一般に販売されています。
1. 工業用薬品
工業用薬品としては30%または50%溶液として販売されています。25kgのポリエチレン缶や200Lのドラムなどの容量での提供が一般的です。有機合成用触媒、還元剤、表面処理剤、酸化防止剤、熱変化防止剤をはじめとする、様々な用途を想定して提供されているため、複数メーカーからの販売があります。
2. 研究開発用試薬製品
次亜リン酸は、研究開発用試薬製品としても、30%もしくは50%溶液として販売されることが一般的です。容量の種類は25g、100g、500gなどがあります。通常、室温で保管可能な試薬製品として取り扱われています。
-
性質
次亜リン酸は、分子量66.00、融点26.5℃、沸点130℃であり、常温では無色透明の油性液体、または潮解性の結晶です。
密度は1.493g/mL、酸解離定数pKaは1.2です。水、アルコール、エーテルに溶解します。また、加熱すると、とに分解されます。
-
性質
ホスフィン酸の融点は26.5℃です。100℃以上で分解し、リン化水素であるホスフィン (PH3) と (PH3O3) を経て、最終的にリン酸 (H3PO4) となります。
-
溶解性
水に易溶, エタノールに可溶。水及びエタノールに溶ける。
-
解説
ホスフィン酸,無色の結晶.密度1.49 g cm-3.融点26.5 ℃.潮解性がある.水,アルコール,エーテルに可溶.pKa 1.244(25 ℃).130 ℃ 以上で不均化反応を起こしてH3PO4とPH3になる.強い還元性があり,Cu2+,Ag+ などを還元する.還元剤として利用するほか,ホスフィン酸塩の原料とする.
森北出版「化学辞典(第2版)
-
用途
還元剤。触媒。金属表面処理、メッキ材料。有機合成(和光試薬時報Vol.65 No.2,p.29(1997))。
-
構造
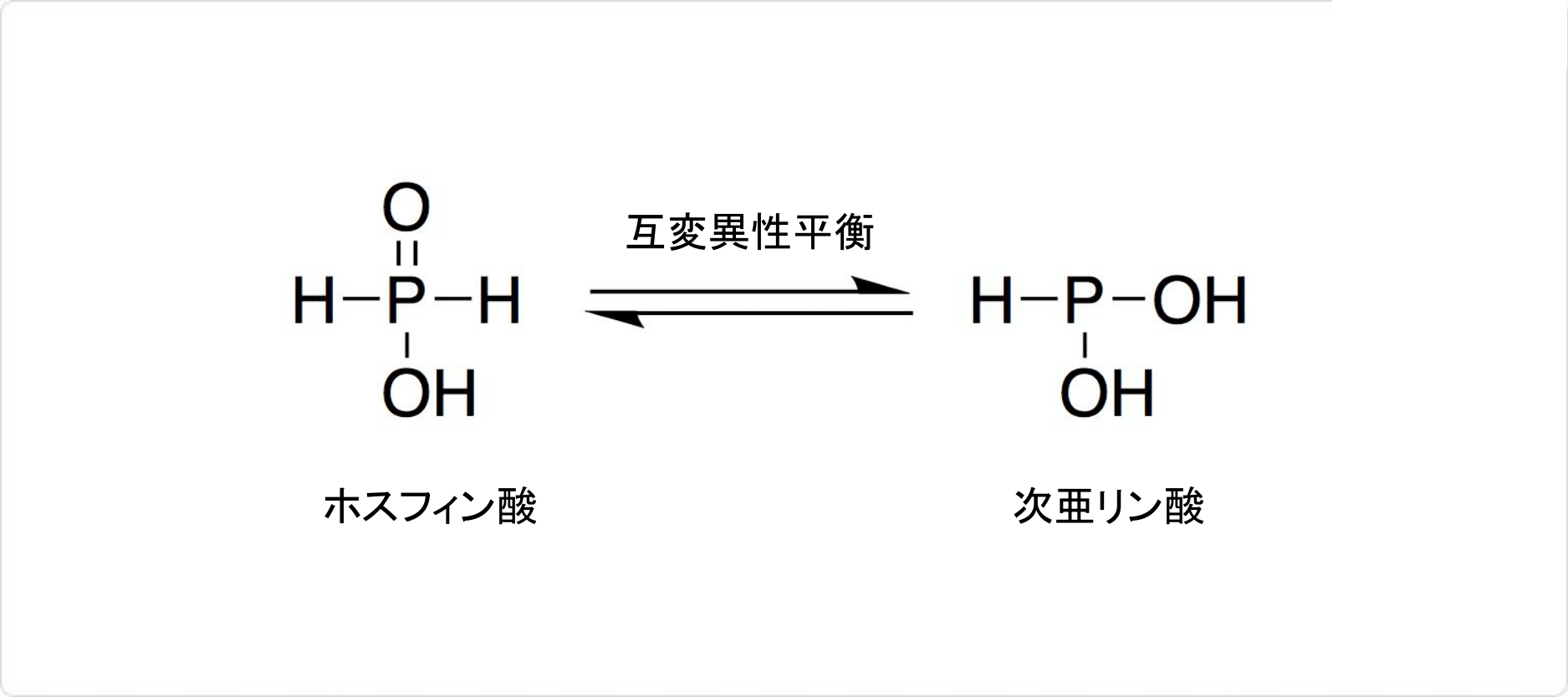
図1. ホスフィン酸の互変異性体
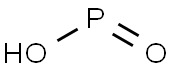
ホスフィン酸は、P-H結合とホスホリル基 (P=O) を有する無機リン化合物です。水素原子の2つがリンに直接結合しており、リンの原子価は5価です。式量は66.0、比重は1.45、化学式はH3PO2で、示性式は(HO)PH2(=O)で表されます。
PH2基を有することは、核磁気共鳴 (NMR) などの物理測定によって確認されています。同じ化学式のと互変異性体の関係です。
-
合成

図2. ホスフィン酸の合成法
工業的にホスフィン酸を合成するために、まず白リンを消石灰で処理することによって、カルシウム塩を生成します。次に、カルシウム塩をナトリウム塩にすることで、ホスフィン酸ナトリウムが生じます。
ホスフィン酸ナトリウムをによって酸の形に変換することで、ホスフィン酸が生成可能です。過酸化水素やヨウ素を用いて、ホスフィンオキシドを酸化する方法でも調製できます。
-
合成
次亜リン酸は、2段階反応によって合成されます。まず、リンをアルカリ性、またはアルカリ性の土質苛性溶液中で煮沸することで、次亜リン酸水溶液が生成します。この際、生成する亜リン酸塩はカルシウム塩として沈殿させ、除去することが可能です。
精製した水溶液を、酸化力のない強酸 (強硫酸など) で処理すると、遊離の次亜リン酸を得ることができます。
-
製法
ホスフィン酸,IUPAC(酸命名法)正式名称はジヒドリドジオキソリン酸(dihydridodioxophosphoric acid).旧名称,次亜リン酸.HO-PⅠ(=O)H2構造の一塩基酸.P原子に2原子のHとOH基,1原子のOが四面体型に結合していて,OH基のH原子は残りの [PH2O2]- と水素結合している.水溶液中でPH3を I2,HClOなどで酸化してつくる.工業的には,白リンを消石灰で処理して得られるCa塩をNa塩にかえてH型イオン交換樹脂カラムを通すと酸水溶液が得られる.
-
効能
酸化防止剤
-
使用上の注意
潮解性あり
-
説明
Hypophosphorous acid is a powerful reducing agent
with a molecular formula of H3PO2. Inorganic chemists
refer to the free acid by this name although its IUPAC
name is dihydridohydroxidooxidophosphorus, or the
acceptable name of phosphinic acid. It is a colorless
low-melting compound, which is soluble in water,
dioxane, and alcohols. The formula for hypophosphorous
acid is generally written H3PO2, but a more descriptive presentation is HOP(O)H2 which highlights
its monoprotic character. Salts derived from this acid
are called phosphinates (hypophosphites).
-
化学的特性
colourless liquid
-
物理的性質
Colorless deliquescent crystals or oily liquid; sour odor; density 1.493 g/cm3;melts at 26.5°C; boils at 130°C; very soluble in water, alcohol and ether; den-sity of a 50% aqueous solution is 1.13 g/mL.
-
使用
Hypophosphorous acid is primarily used for electroless nickel plating. It is involved in the reduction of arenediazonium salts. It acts as an additive in Fischer esterification reactions. Also, it serves as a neutralizing agent, antioxidant, catalyst in polymerization and poly condensation, and wetting agent. Further, it is used in the formulation of pharmaceuticals, discoloration of polymers, water treatment and retrieval of precious or non-ferrous metals. In addition to this, it is used as bleaching agents for plastics, synthetic fibers, decolorizing agent and for color stabilization during the manufacture of chemicals and several plastics.
-
調製方法
Hypophosphorous acid is formed by reaction of barium hypophosphite and sulfuric acid, and filtering off barium sulfate. By evaporation of the solution in vacuum at 80 °C, and then cooling to 0°C, hypophosphorous acid crystallizes.
-
製造方法
Hypophosphorous acid may be prepared by various methods:
1. Boiling white phosphorus with calcium hydroxide:
P4 + 4Ca(OH)2 + 8H2O → 4Ca(H2PO2)2 + 4H2
The calcium salt is soluble in water. Treatment with sulfuric acid yields thehypophosphorous acid:
(H2PO2)2Ca + H2SO4 → 2H3PO2 + CaSO4
The product mixture is filtered to remove insoluble CaSO4. The aqueous solu-tion of hypophosphorous acid is concentrated under reduced pressure.Concentrated baryta water may be used instead of calcium hydroxide.2. By treating sodium hypophosphite, NaH2PO2with an ion-exchange resin.The sodium salt may be produced by boiling white phosphorus with a solutionof sodium hydroxide, a reaction similar to (1) above.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
The above method may be considered safer than that involving heating whitephosphorus with an alkali.
Hypophosphorous acid must be stored below 50°C. It is sold commerciallyas an aqueous solution at various concentrations.
-
定義
ChEBI: A phosphorus oxoacid that consists of a single pentavalent phosphorus covalently bound via single bonds to two hydrogens and a hydroxy group and via a double bond to an oxygen. The parent of the class of phosphinic acids.
-
反応性
Hypophosphorous acid is miscible with water in all proportions and a commercial strength is 30% H3PO2. Hypophosphites are used in medicine. Hypophosphorous acid is a powerful reducing agent, e.g., with copper sulfate forms cuprous hydride Cu2H2, brown precipitate, which evolves hydrogen gas and leaves copper on warming; with silver nitrate yields finely divided silver; with sulfurous acid yields sulfur and some hydrogen sulfide; with sulfuric acid yields sulfurous acid, which reacts as above; forms manganous immediately with permanganate.
-
一般的な説明
Hypophosphorous acid appears as colorless oily liquid or deliquescent crystals with a sour odor. Density 1.439 g / cm3. Melting point 26.5°C. Inhalation of vapors irritates or burns the respiratory tract. Liquid and vapors may irritate or burn eyes and skin.
-
空気と水の反応
Deliquescent. Water soluble.
-
反応プロフィール
HYPOPHOSPHOROUS ACID decomposes when heated into phosphoric acid and spontaneously flammable phosphine. Is oxidized by sulfuric acid with release of sulfur dioxide and sulfur. Reacts explosively with mercury(II) oxide [Mellor, 1940, Vol. 4, 778]. Reacts violently with mercury(II) nitrate [Mellor, 1940, Vol. 4, 993]. Neutralizes bases in exothermic reactions.
-
危険性
Fire and explosion risk in contact with oxidizing agents.
-
健康ハザード
TOXIC; inhalation, ingestion or skin contact with material may cause severe injury or death. Contact with molten substance may cause severe burns to skin and eyes. Avoid any skin contact. Effects of contact or inhalation may be delayed. Fire may produce irritating, corrosive and/or toxic gases. Runoff from fire control or dilution water may be corrosive and/or toxic and cause pollution.
-
火災危険
Non-combustible, substance itself does not burn but may decompose upon heating to produce corrosive and/or toxic fumes. Some are oxidizers and may ignite combustibles (wood, paper, oil, clothing, etc.). Contact with metals may evolve flammable hydrogen gas. Containers may explode when heated.
-
使用用途
次亜リン酸は還元力を持つ物質です。主な用途は「還元剤」「有機合成用触媒」「表面処理剤」「酸化防止剤」「熱変化防止剤」などです。無電解メッキの還元剤や、合成繊維やプラスチックの漂白剤及び脱色剤として、多く利用されています。
その他、ホスフィン酸塩の原料としての用途があります。例えば、など、その他の次亜リン酸の調製に使用されており、これらは「」「乳化剤「湿潤帯電防止剤」として使われている物質です。また、触媒としては「エステル化触媒」「重合および重縮合触媒」など、の用途があります。
-
関連化合物
ホスフィン酸はリンのオキソ酸です。リンのオキソ酸には、リン酸 (英: phosphoric acid) 、 (英: phosphorous acid) 、ホスホン酸 (英: phosphonic acid) 、ペルオキソ一リン酸 (英: peroxomonophosphoric acid) があります。
リン酸の化学式はH3PO4、亜リン酸の化学式はH3PO3、ホスホン酸の化学式はH2PHO3、ペルオキソ一リン酸の化学式はH3PO5です。
リン酸のリンの酸化数は+5、亜リン酸のリンの酸化数は+3、ホスホン酸のリンの酸化数は+3、ペルオキソ一リン酸のリンの酸化数は+5です。
-
化学反応
前述の通り、次亜リン酸は互変異性化しますが、P=O結合を持つHP(O)(OH)2 構造の方が通常熱力学的に安定です。次亜リン酸は、還元力があるため、酸化クロム(III)を酸化クロム(II)に還元します。また、次亜リン酸を加熱すると約110℃で亜リン酸とホスフィンに分解します。
次亜リン酸は、推奨保管条件下で安定ですが、アルカリ性物質、金属類とは激しく反応します。危険有害な分解生成物は、リン酸化物です。保管の際は高温と直射日光、湿気を避けることが必要とされています。
-
使用用途
ホスフィン酸は、有機合成用の触媒や還元剤、金属などの表面処理剤、酸化防止剤、熱変化防止剤、メッキ材料などとして、幅広く使用されています。そのほか、ホスフィン酸塩の原料も使用用途の1つです。
各種ホスフィン酸塩類は、スチールやプラスチックなどへの無電極ニッケルめっきの還元剤、各種還元や医薬品などに使用可能です。無電解ニッケルめっきの場合は、還元剤であるホスフィン酸塩が酸化されることによって、亜リン酸塩になります。この反応時に、電子を放出することで、ニッケルイオンを還元し、となります。
-
概要
次亜リン酸 (英: Hypophosphorous acid) とは、リンのオキソ酸の1種で、分子式H3PO2で表される無機酸です。
次亜リン酸と (英: Phosphinic acid) は互変異性体の関係にあるため、ホスフィン酸の名称で呼ばれる場合もあります。CAS登録番号は6303-21-5です。次亜リン酸は強力な腐食性を持つ化合物であり、目や皮膚と接触すると、失明や炎症を引き起こす可能性があります。
-
純化方法
Phosphorous acid is a common contaminant of commercial 50% hypophosphorous acid. Jenkins and Jones [J Am Chem Soc 74 1353 1952] purified this material by evaporating about 600mL in a 1L flask at 40o, under reduced pressure (in N2), to a volume of about 300mL. After the solution was cooled, it was transferred to a wide-mouthed Erlenmeyer flask which was stoppered and left in a Dry-ice/acetone bath for several hours to freeze (if necessary, with scratching of the wall). When the flask was then left at ca 5o for 12hours, about 30-40% of it liquefied, and was again filtered. This process was repeated, then the solid was stored over Mg(ClO4)2 in a vacuum desiccator in the cold. Subsequent crystallisations from n-butanol by dissolving it at room temperature and then cooling in an ice-salt bath at -20o did not appear to purify it further. The free acid forms deliquescent crystals m 26.5o and is soluble in H2O and EtOH. The NaH2PO2 salt can be purified through an anion exchange resin [Klement Z Anorg Allgem Chem 260 267 1949.]
-
参考文献
J.M. Cooper, J. Phys. Chem., 74, 955 (1970), DOI: 10.1021/j100699a052.