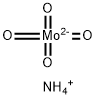-
性質
モリブデン酸アンモニウムは、白色もしくはほとんど白色の結晶性粉末あるいは粉末で無臭です。モリブデン酸アンモニウムは水に溶けますが、やには溶けにくいです。
通常モリブデン酸は毒性が低いため、これまでに事故はほとんど報告されていません。
-
解説
いわゆるオルト塩(NH4)2MoO4も得られているが,この名称の市販品は,七モリブデン酸六アンモニウム四水和物,通称,パラモリブデン酸アンモニウム(NH4)6[Mo7O24]・4H2Oであることが多い.テトラオキシドモリブデン酸(2-)二アンモニウム:(NH4)2MoO4(196.01).MoO3と濃アンモニア水とを反応させ,アルコールを加えて沈殿させると得られる.無色の単斜晶系結晶.空気中に放置すると徐々にアンモニアを失う.水,酸などに可溶.MoO42-は pH 7以上で水溶液中に存在する.pH < 7では七モリブデン酸(6-)イオン,八モリブデン酸(4-)イオンとの平衡が存在する.森北出版「化学辞典(第2版)
-
構造
モリブデン酸アンモニウム (英: Ammonium heptamolybdate) は、最も一般的なモリブデン化合物の一つです。モリブデン酸アンモニウムは通常、(NH4)6Mo7O24•4H2Oという四水和物ですが、(NH4)6Mo7O24•2H2Oのような二水和物も知られています。
モリブデン酸アンモニウムの分子量は1,163.9、四水和物の分子量は1,235.86です。モリブデン酸アンモニウムに存在する、七モリブデン酸イオンであるMo7O246-は、パラモリブデン酸イオンとも呼ばれています。
「Ammonium molybdate」単に言う場合には、オルトモリブデン酸アンモニウムである(NH4)2MoO4やその他の化合物を指すこともあります。結晶構造の解析の結果、すべてのモリブデン中心は八面体です。オキシド配位子は、いくつかが末端に位置し、いくつかが二重架橋していて、若干が三重架橋しています。
-
製造法
モリブデン酸ビスアンモニウムは,モリブデン(Ⅵ)のオキソ酸であるモリブデン酸のアンモニウム塩。オルトモリブデン酸塩(NH4)2MoO4(正式名称はモリブデン(Ⅵ)酸アンモニウム)は、酸化モリブデンを熱濃アンモニア水に溶かして結晶化させると得られる。希アンモニア性水溶液からはパラモリブデン酸塩(NH4)6Mo7O24・4H2O(正式名称はテトラコサオキシド七モリブデン(Ⅵ)酸アンモニウム四水和物)を得るが、パラモリブデン酸のようにいくつかの単量体のオキソ酸が縮合して生成した多量体オキソ酸をイソポリ酸という。パラモリブデン酸アンモニウムの濃硝酸溶液にリン酸の溶液を加えると、ドデカモリブドリン酸水素アンモニウム(NH4)2H(PMo12O40)・H2O(正式名称はテトラコンタリン十二モリブデン(Ⅵ)酸アンモニウム一水和物)の黄色沈殿を得る。ヒ酸でも同様な沈殿を生じ、リンやヒ素の検出反応に利用されるが、この種の複数の元素の縮合オキソ酸をヘテロポリ酸という。[岩本振武]
-
合成
(VI) (英: molybdenum(VI) oxide) を、を過剰量含んだ水溶液に溶解して、室温で溶液を蒸発させることで、容易にモリブデン酸アンモニウムが生成します。このとき溶液が蒸発する間に、アンモニアはなくなります。
この方法によって、モリブデン酸アンモニウムの四水和物で作られた、6面の透明なプリズムを形成することが可能です。パラモリブデン酸アンモニウムの溶液は、酸と反応することで、アンモニウム塩とモリブデン酸 (英: Molybdic acid) を生じます。濃縮した溶液のpHは、5から6の間です。
-
化学的特性
Ammonium molybdate is a colorless, white or slightly greenish-yellow powder. It is used in chemical analysis for the determination of phosphorus. From a nitric acid solution it precipitates phosphorus in the form of ammonium phosphomolybdate having the formula (NH4)3PO4-12MoO3 after drying at 110 °C(230°F). Some of the phosphomolybdic acids are used as reagents for the alkaloids and in the analysis and separation of the alkali metals.
-
使用
Ammonium molybdate has been used to prepare phosphomolybdates. (NH4)2MoO4 was used as an analytical reagent for quantitative analysis of phosphates, silicates, arsenates and lead in their aqueous solutions. At saturated concentration, (NH4)2MoO4 was used to perform cryo-negative staining and as a negative stain in biological electron microscopy. Ammonium molybdate was used in study of crystallisation of cell-free-expressed membrane proteins.
-
調製方法
Pure molybdic oxide (99.95% MoO3) is prepared by sublimation of technical oxide or by calcining ammonium molybdate. Metallic molybdenum powder is prepared commercially by hydrogen reduction of either pure molybdic oxide or ammonium molybdate in a two-step process.
-
定義
ChEBI: Ammonium molybdate is an ammonium salt composed of ammonium and molybdate ions in a 2:1 ratio. It has a role as a poison. It contains a molybdate.
-
一般的な説明
Ammonium molybdate can be prepared by dissolving molybdenum trioxide in ammonia.
-
使用用途
モリブデン酸アンモニウムは、幅広い分野で使用されています。その中でもまず挙げるべきなのが、金属モリブデンの原料としての利用です。を酸化剤とした「Trost酸化」では、モリブデン酸アンモニウムの環境下でおこる反応から触媒の原料として利用されています。
金属表面処理剤や難燃剤、減煙剤としての使用や、セラミックスや焼結金属の添加剤としても使用可能です。さらに、河川水、海水、色素などの水溶液中のケイ酸塩、リン酸塩、ヒ酸塩、鉛の定量のために、分析試薬として用いられています。
その他、レクリエーショナルドラッグの検出も用途の一つです。フレーデ試薬の成分として利用されています。また、3-5%濃度ではトレハロースの存在下での生体用電子顕微鏡のネガティブ染色として、飽和濃度ではクライオネガティブ染色に用いることが可能です。
脱水素脱硫結晶の生成だけでなく、金属モリブデンやセラミックスの製造にも役立ちます。
-
安全性プロファイル
Poison by ingestion and
intraperitoneal routes. Moderately toxic by
other routes. An irritant. See also
MOLYBDENUM COMPOUNDS. When
heated to decomposition it emits toxic
fumes of NH3 and NOx.
-
職業ばく露
It is used as an analytical reagent, in
pigments and in the production of molybdenum metal and
ceramics.
-
輸送方法
There are no known UN/DOT restrictions.
-
純化方法
Crystallise the salt from water (2.5mL/g) by partial evaporation in a desiccator. [Sturdivant J Am Chem Soc 59 630 1937, Grüttner & Jauder in Handbook of Preparative Inorganic Chem (Ed. Brauer) Academic Press Vol II p 1711 1965.]
-
不和合性
Incompatible with oxidizers (chlorates,
nitrates, peroxides, permanganates, perchlorates, chlorine,
bromine, fluorine, etc.); contact may cause fires or explosions.
Keep away from alkaline materials, strong bases,
strong acids, oxoacids, epoxides; chemically active metals
(such as potassium, sodium, magnesium and zinc) may
cause a violent reaction.