钡
- CAS号:7440-39-3
- 英文名:Barium
- 中文名:钡
- CBNumber:CB0854186
- 分子式:Ba
- 分子量:137.33
- MOL File:7440-39-3.mol
- 熔点 :725 °C(lit.)
- 沸点 :1640 °C(lit.)
- 密度 :3.6 g/mL at 25 °C(lit.)
- 储存条件 :water-free area
- 溶解度 :reacts with H2O; slightly soluble in ethanol
- 形态 :rod
- 比重 :3.51
- 颜色 :Silver-gray
- PH值 :0.5 (20°C in H2O)
- Flame Color :Light apple green
- 电阻率 (resistivity) :50.0 μΩ-cm, 20°C
- 水溶解性 :soluble with H2 evolution in cold H2O and hot H2O; slightly soluble alcohol; insoluble benzene [CRC10]
- 敏感性 :air sensitive, moisture sensitive
- Merck :13,967
- 暴露限值 :TLV-TWA 0.5 mg/m3 (for soluble compounds) (ACGIH and MSHA); IDLH (for soluble compounds) 250 mg/m3 (NIOSH). .
- 稳定性 :Stability Reacts vigorously or violently with acids, water, tetrachloromethane, small halogenated hydrocarbons. Should be stored under an inert material such as petroleum ether to exclude air. Flammable.
- CAS 数据库 :7440-39-3(CAS DataBase Reference)
- EPA化学物质信息 :Barium (7440-39-3)
- 危险品标志 :C,Xi,F
- 危险类别码 :25-26-34-36/37/38-14/15-11
- 安全说明 :23-26-36-36/37/39-45-43-36/37-16
- 危险品运输编号 :UN 3264 8/PG 3
- 职业暴露等级 :C
- 职业暴露限值 :TWA: 0.5 mg/m3
- WGK Germany :3
- RTECS号 :CQ8370000
- TSCA :Yes
- 海关编码 :2805 19 10
- 危险等级 :8
- 包装类别 :III
- 毒害物质数据 :7440-39-3(Hazardous Substances Data)
- 毒性 :An element; the heaviest of the stable alkaline earths. Barium sulfate is used as a diagnostic aid in radiology due to its radio-opaqueness and, because of its insolubility and lack of absorption, it is safe barring iatrogenic episodes. Poisoning usually results from deliberate or accidental ingestion of soluble barium compounds. The Ba2+ ion is a muscle poison due to the blocking of the K1 channels of the Na+/K+ pump in cell membranes. Because cases of barium poisoning are accompanied by severe hypokalemia, potassium infusion is an effective antidote. The toxicity of barium compounds depends on their solubility, with the free ion being readily absorbed from gastrointestinal tract or lung, whereas the sulfate is essentially unabsorbed. Thus, administration of soluble sulfates immediately after ingestion is another effective antidote.
- 立即威胁生命和健康浓度 :50 mg Ba/m3
钡 MSDS
钡
钡性质、用途与生产工艺
-
简介
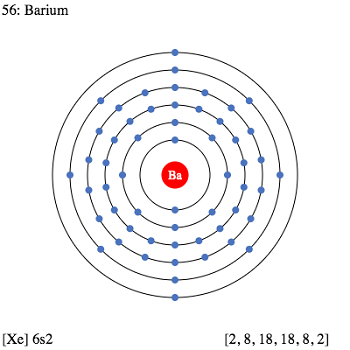
元素Ba; 原子序数56; 原子量137.327; IIA组(第2主组)碱土元素。 钡是银白色金属。自然界中它仅存在于含有元素混合物的矿石中。重要的组合是过氧化物,氯化物,硫酸盐,碳酸盐,硝酸盐和氯酸盐。钡与铅,钾,铂,镁,硅,锌,铝和汞形成合金和金属间化合物。钡化合物与也是碱土金属的钙和锶化合物显示出密切的关系。现已鉴定出25种钡同位素,其中138Ba最丰富,其余为不稳定同位素,半衰期从140Ba的12.8天到143Ba的12 s。这些同位素中的两个131Ba和139Ba在研究中用作放射性示踪剂。
-
发现历史
中世纪初,炼金术士即对一些钡矿石有所了解。在意大利博洛尼亚发现的一些被称为“博洛尼亚石”的平滑卵石状重晶石块曾得到炼金术士的注意,因为这些矿石在受到光照后会发光数年。1602年,卡西奥劳罗(V. Casciorolus)描述了这种用有机物加热重晶石发出磷光的性质。 1774年,卡尔·威廉·舍勒发现重晶石中含有一种未发现的新元素,但无法分离提纯这种元素,只能得到它的氧化物,即氧化钡。两年后,约翰·戈特利布·甘恩也在相同的研究中得到了氧化钡。氧化钡最早被Guyton de Morveau称作“barote”,后来被拉瓦锡改作“baryta”。同在18世纪,英国矿物学家威廉·威灵宁在坎伯兰的铅矿中注意到一种沉重的矿物,现在称为毒重石,其主要成分为碳酸钡。1808年,汉弗里·戴维首次通过电解熔融的钡盐分离钡单质。戴维通过与钙类似的命名方法,用重晶石(baryta)的名称加上表示元素的后缀-ium来命名钡(barium)。罗伯特·本生与奥古斯都·马修森通过电解氯化钡和氯化铵的熔融混合物来获得纯钡。
-
来源
钡是地壳中第17个最丰富的元素,约占地壳的0.05%。 它在镁铝石矿中发现,其为碳酸钡(BaCO3)和重晶石,称为硫酸钡(BaSO4)。 纯钡金属在地球上不存在,仅以化合物形式存在或存在于矿物和矿石中。 在密苏里州,阿肯色州,乔治亚州,肯塔基州,内华达州,加利福尼亚州,加拿大和墨西哥发现了钡矿石,它是通过在高温真空下使用铝或硅还原氧化钡(BaO)制成的。 它也是通过在约950℃的温度下电解熔融氯化钡(BaCl2)来生产的,其中钡金属在阴极收集,氯气在阳极排放。

-
应用
钡的最重要用途是作为电子管中的清除剂。这种金属通常为粉末形式或与铝形成合金,用于去除真空和电视显像管中的最后痕量气体。钡合金具有许多应用。它被结合到酸性电池的铅合金网格中以实现更好的性能;并添加到脱氧合金中的钢水和金属中以降低氧含量。钡薄膜用作润滑剂,适合在高温下在真空X射线管中的阳极转子上以及在用于火花塞的合金上使用。该元素的几种放射性同位素可用于核反应和光谱学中。
-
制备
开采出的矿石需要经过洗涤、粉碎、分类,并与石英分离。如果石英渗入矿石过深,或者矿石中铁、锌、铅含量过高,则须使用泡沫浮选法处理。最终得到的产物是质量分数98%的重晶石,纯度不低于95%,且铁和二氧化硅含量极少。
随后使用碳还原硫酸钡:
BaSO4 + 2 C → BaS + 2 CO2↑
生成了水溶性的硫化钡之后,便可以作为其它产品的原料:与氧反应得到硫酸钡,与硝酸生成硝酸钡,与二氧化碳生成碳酸钡等。硝酸钡加热分解可以产生钡的氧化物。
金属钡可以用氧化钡在1,100 °C(2,010 °F)下与铝反应得到。
其中首先生成金属互化物BaAl4:
3 BaO + 14 Al → 3 BaAl4 + Al2O3
BaAl4是与氧化钡反应生成金属的中间产物。注意并非全部钡元素都被还原。
8 BaO + BaAl4 → Ba↑ + 7 BaAl2O4
剩余的氧化钡与生成的氧化铝反应:
BaO + Al2O3 → BaAl2O4
总反应为:
4 BaO + 2 Al → 3 Ba↑ + BaAl2O4
钡蒸气在氩气气氛中冷凝并装入模具中。这种方法在商业上用于生产超纯钡。通常市面上出售的钡纯度约99%,主要杂质为锶和钙(含量达到0.8%和0.25%),而其他杂质成分小于0.1%。 硫酸钡与硅在1,200 °C(2,190 °F)下亦可发生类似的反应得到钡和偏硅酸钡。但工业上一般不会使用电解法,因为钡易溶于熔融的卤化物,并且产物纯度较低。
- 危害性 粉末形式的钡金属在室温下易燃。 它必须存储在无氧气氛或石油中。 钡的许多化合物都是有毒的,尤其是氯化钡,它会影响心脏的功能,引起心室纤颤,心律失常,甚至导致死亡。几种钡的化合物具有爆炸性,如果被摄入或吸入,也具有毒性。 在实验室或工业中使用钡和其他碱金属时应格外小心。
- 毒性 粉尘在常温下易自燃。遇热、火焰或化学反应便能引起着火和爆炸。易遇水分解,并与酸类发生剧烈反应,放出氢气,可被反应热引起燃烧。金属钡遇水即生成氢氧化钡,具有腐蚀作用,同时水溶性钡盐有很大毒性。误服或吸入粉尘会引起中毒。应使患者脱离污染区,安置休息并保暖。不慎溅入眼睛用大量水冲洗,严重者就医诊治。皮肤接触先用水冲洗,再用肥皂彻底洗涤,如有灼伤就医诊治。误服立即漱口。急送医院救治。
- 化学性质 黄银白色软金属。相对密度3.62。熔点729℃。沸点1640℃。体心立方:α=0.5025 nm。熔化热7.66 kJ/mol;汽化热149.20 kJ/mol。蒸气压:0.00133 kPa(629℃),1.33 kPa(1050℃),101.3 kPa(1640℃)。电阻率29.4μΩ?cm。电负性1.02。:Ba2+半径0.143 nm。导热系数18.4(25℃)w/(m?K)。热膨胀系数:线膨胀系数1.85×10-5m/(m?℃)。在常温下很容易与水反应释出氢气,微溶于酒精,不溶于苯。
- 用途 广泛用于合金,有铅、钙、镁、钠、锂、铝及镍等合金。用于清除无线电真空管中残留的微量气体。
- 用途 用于制钡盐、合金、焰火、核反应堆等,也是精炼铜时的优良除氧剂。
- 生产方法 铝热还原法将硝酸钡热分解制得氧化钡,用细粒铝作还原剂,配料比按3BaO:2Al进行,把氧化钡和铝先制成团矿,将此团矿装入蒸馏器,加热至1150℃进行还原蒸馏,制得钡纯度为99%。
- 类别 遇水易燃物品
- 毒性分级 剧毒
- 急性毒性 口服-狗 LDL0: 1 毫克/公斤 (参考:金属钡)
- 爆炸物危险特性 遇水产生氢气易爆
- 可燃性危险特性 空气中自燃; 遇水易燃; 遇水、醇、酸产生易燃氢气; 水和胃酸可溶解钡盐中毒
- 储运特性 库房通风低温干燥; 与酸、氧化剂、卤代烃分开存放
- 灭火剂 石墨粉、干砂
- 职业标准 TWA 0.5毫克(钡)/立方米
- 更新日期:2025/02/05
- 产品编号:014454
- 产品名称:固态树状钡晶体, 99.9% (metals basis) Barium crystalline dendritic solid, 99.9% (metals basis), Thermo Scientific Chemicals
- CAS编号:7440-39-3
- 包装:5g
- 价格:5159元
- 更新日期:2025/02/05
- 产品编号:010103
- 产品名称:钡棒, 22mm (0.9in) 直径, 99+% (metals basis), Sr ≤0.8% Barium rod, 22mm (0.9in) dia, 99+% (metals basis), Sr ∣<0.8%, Thermo Scientific™
- CAS编号:7440-39-3
- 包装:100g
- 价格:2821元
- 公司名称:Panreac Quimica S.L.U.
- 联系电话:--
- 电子邮件:info.es@itwreagents.com
- 国家:西班牙
- 产品数:117
- 优势度:58
- 公司名称:Eurocontal SA
- 联系电话:--
- 电子邮件:info@eurocontal.com
- 国家:西班牙
- 产品数:29
- 优势度:55