乳过氧化物酶的制备方法
发布日期:2020/10/20 9:13:35
背景及概述[1]
乳过氧化物酶属氧化还原酶类。编号:EC1.11.1.7。存在于牛乳、眼泪、唾液等体液中的一种过氧化物酶,催化过氧化氢氧化底物并生成水。乳过氧化物酶(Lactoperoxidase,LPO)是过氧化物酶家族的成员之一,广泛分布于自然界中,包括人类、植物和动物体内,是乳中天然含有的一种酶类。乳过氧化物酶存在于哺乳动物的乳腺、唾液和泪液腺体及其各自的分泌物,即牛奶、唾液和眼泪。它是牛乳和人乳中常见的成分之一,并且存在于迄今为止已经检测过的所有哺乳动物乳中。乳过氧化物酶是发现的首个分泌型过氧化物酶,且在保护哺乳期妇女的乳腺以及新生儿肠道免受病原微生物侵害方面起重要作用,是机体防御体系的一部分。乳腺、唾液和泪腺中的过氧化物酶在化学和免疫学上性质相似。
理化性质及结构[2]
LPO是牛乳中含量最丰富的酶之一,是一种等电点(pI)为15的碱性蛋白,由1条多肽链构成,包括612个氨基酸残基和15个半胱氨酸残基,相对分子质量约78kDa。含铁量0.07%,含有1个血红素(正铁血红素),其折叠结构包括23%α-螺旋、65%β-折叠和12%无序结构。人类蛋白质的氨基酸序列也有612个残基,包括16个半胱氨酸。作为一种糖蛋白,LPO含有4~5个N-糖基化位点,碳水化合物含量约10%。对于某个给定的LPO,糖基化和部分脱酰胺化的差异可引起显著的色谱和电泳异质性,牛乳中乳过氧化物酶(bLPO)具有至少10个酶活性相似的级分。LPO中含有一个钙离子,它能与LPO紧密地结合,稳定其分子构象,因此钙离子在LPO的稳定性和结构完整性中起重要作用。脊椎动物过氧化物酶(乳过氧化物酶(LPO)、甲状腺过氧化物酶(TPO)、髓过氧化物酶(MPO)和嗜酸性粒细胞过氧化物酶(EPO))的活性位点是血红素,一种原卟啉IX衍生物,通过2个酯键共价结合到远端天冬氨酸和谷氨酸残基。这些对脊椎动物过氧化物酶特异性的共价键导致血红素的对称性和平面性的改变,从而产生了这些蛋白质独特的光谱性和氧化还原性质。序列分析显示,人乳过氧化物酶(hLPO)分别与人髓过氧化物酶(hMPO)、人嗜酸性粒细胞过氧化物酶(hEPO)和人甲状腺过氧化物酶(hTPO)有57%,58%和46%的序列同一性。这些高水平的序列同一性表明,半胱氨酸过氧化物酶(XPO)亚科的种酶可能具有显著的结构相似性。
稳定性[2]
1. 热稳定性
研究表明,LPO在渗透物和缓冲液中的热稳定性小于在乳清或乳汁中,钙离子浓度似乎对其热敏性有较大影响,且热变性的起始温度为70℃。LPO在酸性条件(pH5.3)下的热稳定性较差,其原因可能是由于分子中钙的释放。LPO是牛奶中热稳定性最强的酶之一,其被破坏程度已被用作牛乳巴氏灭菌效率的指标。LPO仅在74℃通过短时间的巴氏灭菌被部分灭活,剩余活性来催化硫氰酸盐和过氧化氢之间的反应。
2. pH
在pH4.4~6.7的范围内,LPO为低质量浓度(0.5mg/L),pH5.4时的活性降低最快,每15min降低15%;而LPO浓度为高质量浓度(25mg/L),3h内不丧失活性。这种差异可能是由于在低浓度下LPO对玻璃容器表面的吸附作用,并且表明在测定LPO最终稀释浓度时必须快速进行分析。LPO在pH3时保存会失活,在pH<4时部分变性,当pH达10左右时则不会失活(室温下)。使用2,2’-联氮双-(3-乙基苯并噻唑啉-6-磺酸)(ABTS)作为底物,研究得出LPO催化反应的最适pH为5~6,但取决于ABTS和H2O2的浓度。
3. 蛋白水解酶
LPO对许多蛋白水解酶稳定。据报道,胰蛋白酶和嗜热菌蛋白酶不会使天然乳过氧化物酶失活,糜蛋白酶只能使其缓慢地失活。LPO不会被pH5的婴儿胃液灭活,但会在pH2.5时被胃蛋白酶灭活。
4. 光化学
在核黄素存在的情况下,LPO似乎对光非常敏感。例如,LPO在10℃温度下暴露6000lux持续4h后,在乳、乳清和渗透物中分别被灭活55%,75%和97%。在50mg/L的LPO缓冲溶液中(pH6.7),除非加入核黄素,否则不发生LPO的光化学灭活。光化学灭活不可逆,但通过加入半胱氨酸可以高效地防止光化学灭活现象。
浓度和活性[2]
在牛乳中,LPO是次于黄嘌呤氧化酶第二丰富的酶。其在牛乳中的质量浓度约为30mg/L,约占乳清蛋白的1%。人乳中LPO约为0.77±0.38mg/L;纯化后的日本香川地区荷斯坦牛乳与娟姗牛乳清蛋白中LPO含量分别为0.2729和0.3807 mg/mL。不同于其他的抗菌蛋白,牛初乳中的LPO浓度较低,然而在产后的3~5d,浓度可迅速增长到值。
抑菌机理[2]
1)反应机理
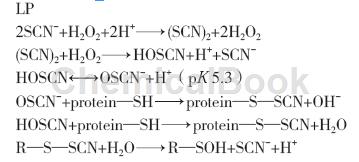
LPO与硫氰酸盐(SCN-)和过氧化氢(H2O2)共同存在时,才具有抗菌活性,称为乳过氧化物酶体系(Lactoperoxidasesystem,简称LPOS),LPOS是乳中的一种天然抗菌体系。在H2O2存在的情况下,LPO催化氧化SCN-,产生HOSCN和OSCN-等氧化产物,氧化细菌蛋白质的巯基(—SH),使其转化为硫(氧)基衍生物,阻碍细菌的新陈代谢及增殖,从而达到抑制细菌的目的。虽然乳蛋白质中也含有少量—SH基,但由于在自然状态下是被包埋在分子内部,不易与LPOS接近,所以OSCN-的主要作用是存在于乳中细菌表面上的—SH,对β-乳球蛋白等乳蛋白没有影响。SCN-的氧化产物介导的LPO催化反应来氧化蛋白质(酶)巯基:
2)抑菌活性
不同种类的细菌表现出对LPOS不同程度的抗性。革兰氏阴性的过氧化氢阳性菌如假单胞菌属、大肠菌群、沙门氏菌属和志贺氏杆菌不仅会被LPO抑制生长,且在外源提供H2O2以及适宜的培养基条件下(pH、温度、孵育时间、细胞密度等),这些细菌可能会被直接杀死;革兰氏阳性的过氧化氢阴性菌如链球菌和乳杆菌通常会被LPOS抑制但不会被直接杀死。上述细菌对LPO的敏感度差异可能是由于细胞壁结构及其屏障性质的不同而形成的。I-是所有卤化物中最容易氧化的,LPO催化I-产生I2,并且根据pH和I-浓度大小,还存在HIO和IO-。所以当SCN-和I-都存在于LPOS时,反应机理会更加复杂。在生物体液中,SCN-/I-比例通常为10︰100,并且SCN-能更有效地与I-竞争LPO的催化氧化,表明I-的影响可以忽略不计。然而(SCN)2可将I-氧化成I2,使得在存在I-的情况下,SCN-的氧化可能间接产生I2。由于LPO-H2O2-SCN-系统主要发挥抑菌作用,而LPOH2O2-I-系统则为杀菌作用,因此即使只有少量的I-氧化,对于抗微生物活性都会有重要的影响。据报道,SCN-和I-作为电子给体,LPOS主要体现杀菌作用,并且还能有效地杀死酵母和霉菌。
制备[2-3]
开发LPO的问题是其分离过程烦琐、纯化困难、制造成本较高,难以实现商业化,所以使用不同的分离纯化技术来提取LPO一直是许多研究的重点,探索操作简单方便、纯化快速、成本低、效率高、开发潜力大的新型分离提纯方法是今后要努力发展的方向。国外已有研究用不同的纯化方法来提取LPO,如CM-Sephadex离子交换色谱法、Sephadexg-100凝胶过滤色谱法、苯基-琼脂糖疏水亲和层析、Toyopearl-SP阳离子交换层析法等。然而这些研究的纯化方法比
较复杂且耗时长。此外,还有耦合IgG进行阳离子交换色谱和免疫亲和层析法,用于从乳清中提纯LPO。用阳离子交换膜从牛乳清中分离LPO且结果显示,通过梯度洗脱可以得到高纯度LPO,但回收率为73%,需要进一步提高。Pan等[38]制备一种嵌入球型纤维素的阳离子交换复合冷冻凝胶,用于从牛乳清分离LPO,获得约92%的回收率,表明此发明的阳离子交换复合冷冻凝胶在从牛乳清分离少量蛋白如LPO中是非常有前景的,需要进一步的验证和探索。还有研究使用硫酸铵沉淀和一步CM-纤维素阳离子交换层析法从牛乳清中分离高纯度LPO,对工业应用方面的发展可能会有一定帮助。通过使用Sepharose4B-L-酪氨酸-磺酰胺亲和层析的方法从牛奶中一步纯化LPO,回收率为62.3%,此纯化方法可多次应用,且成本较低,耗时较少;同时该研究结果表明磺胺对于LPO的动力学特性及其竞争性抑制作用,今后此方法有望指导其他过氧化物酶分离提纯的开发。近年来,有研究通过使用染料亲和层析从乳清中纯化LPO,纯化率最高可达86.5%±3.8%,纯化因子为46.1±1.1,表明活性红4-琼脂糖凝胶可以应用于一步纯化牛乳中LPO,且使用不同色谱载体的染料亲和层析直接从乳清中回收和纯化LPO有不错的应用前景。
中国在这方面的研究相对较少,如采用超滤-离子交换色谱分步洗脱法,对牛初乳中的LPO进行分离和纯化,结果显示该酶回收率为76.17%,其最适pH为5.0~5.5,最适温度为55℃。在70℃和75℃时LP酶活的热失活曲线呈现一般植物过氧化物酶失活的双相特征。采用强阳离子交换色谱梯度洗脱法,对牛乳中的LPO进行分离和纯化,利用SDSPAGE定性检测,分离出的LPO显示为单一区带,相对分子质量为76186U。该酶回收率为83.07%,纯化倍数达44.63倍。近期有研究使用双水相萃取技术从牛乳乳清中提取LPO,与一些传统的分离方法相比,双水相萃取技术所使用的分离设备简单,在温和条件下进行简单操作,其获得产品的回收率和纯度较高,其酶活回收率和纯化倍数分别为153.59%和1.99倍。今后的研究侧重于确定牛奶中分离纯化LPO的纯化程度和酶活性等,从而为LPO的大规模开发提供科学依据。
主要参考资料
[1] 营养科学词典
[2] 乳过氧化物酶研究进展
[3] CN201510367541.2一种采用超滤法辅助硫酸铵盐析提取乳过氧化物酶的方法