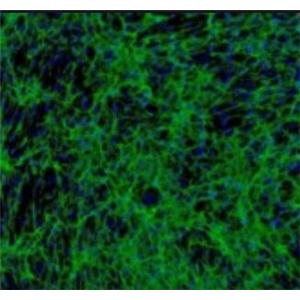
大鼠膀胱成纤维细胞的应用
发布日期:2020/10/18 17:56:53
背景[1-3]
大鼠膀胱成纤维细胞分离自膀胱组织;膀胱是一个储尿器官,在哺乳类动物,它是由平滑肌组成的一个囊形结构,位于骨盆内,其后端开口与尿道相通。膀胱与尿道的交界处有括约肌,可以控制尿液的排出。膀胱壁由三层组织组成,由内向外为黏膜层、肌层和外膜。肌层由平滑肌纤维构成,称为逼尿肌,逼尿肌收缩,可使膀胱内压升高,压迫尿液由尿道排出。在膀胱与尿道交界处有较厚的环形肌,形成尿道内括约肌。在括约肌收缩能关闭尿道内口,防止尿液自膀胱漏出。膀胱壁分为三层:即浆膜层(蜂窝脂肪组织)、肌肉层(逼尿肌、膀胱三角区肌)和黏膜层(极薄的一层移行上皮组织)。成纤维细胞(Fibroblast)是疏松结缔组织的主要细胞成分,由胚胎时期的间充质细胞分化而来。成纤维细胞较大,轮廓清楚,多为突起的纺锤形或星形的扁平状结构,其细胞核呈规则的卵圆形,核仁大而明显。
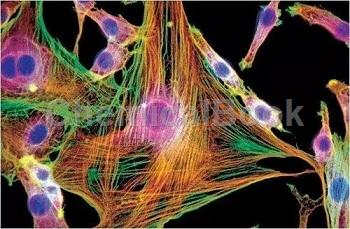
细胞特性[3-6]
成纤维细胞功能活动旺盛,细胞质嗜弱碱性,具明显的蛋白质合成和分泌活动,在一定条件下,它可以实现跟纤维细胞的互相转化;成纤维细胞对不同程度的细胞变性、坏死和组织缺损的修复有着十分重要的作用。刚分离的膀胱成纤维细胞呈圆形、折光性良好,悬浮于培养基中。30min细胞贴壁,其中部分开始伸出伪足,表现为小的突起;6h后细胞基本贴壁完全,伸展成梭形,胞核清晰,分布较均匀,散在生长,不聚集成团;细胞生长迅速,5-7天即呈融合状态,细胞排列紧密,有的交叉重叠生长,平坦、胞体较大,细胞质透明,细胞核较大,呈椭圆形,颜色淡。细胞融合,并彼此连接成网状;细胞呈突起的纺锤形或星形的扁平分布。膀胱成纤维细胞分泌的生长因子是一种具有多功能的促有丝分裂原,研究已表明其参与恶性肿瘤的形成过程。近年来,碱性成纤维细胞生长因子在膀胱癌发病过程中的作用、与生物学行为之间的关系以及治疗上的应用已受到重视。
应用[7][8]
用于氯胺酮性膀胱纤维化中TGF-β1调控膀胱上皮细胞EMT的实验研究。
长期滥用毒品氯胺酮(ketamine)会引发膀胱间质炎症(ketamine-induced cystitis,KC),主要临床表现为尿频、尿急、尿痛、排尿困难及急迫性尿失禁等。膀胱纤维化是中晚期KC患者的严重并发症。膀胱壁由于纤维结缔组织积聚而发生重塑,引起膀胱纤维化、挛缩,使其变为小容量、高压力的低顺应性膀胱,导致膀胱贮尿和排尿功能障碍,进一步发展会导致上尿路积水和肾功能损害,危及生命。
目前少有研究涉及ketamine引发膀胱纤维化的机制。上皮-间质转化(epithelial-mesenchymal transitions,EMT)是指上皮细胞失去极性、在形态学上向间质细胞转变的生物学过程。目前已证实EMT广泛参与肾脏、肝脏、肠壁及肺脏的纤维化,并已成为有效终止、逆转脏器纤维化的重要靶点,然而其在膀胱纤维化中的作用尚未见报道。从EMT介导器官纤维化入手,结合体内外模型,通过分子机制研究阐明TGF-β1信号通路介导的EMT在KC纤维化发生发展中的机制。通过TGF-β1调节人膀胱上皮细胞EMT的分子机制研究培养人永生化膀胱上皮(SV-HUC-1)细胞,CCK-8法检测ketamine(5-125μg/ml)对细胞活力的影响。Ketamine(125μg/ml)刺激SV-HUC-1细胞72h,相差显微镜观察细胞形态变化。Ketamine(125μg/ml)刺激细胞24h,荧光定量PCR法检测EMT标志物(E-cadherin、FSP1、Vimentin、Fibronectin、α-SMA)表达。Ketamine(5 to 125μg/mL)刺激细胞48h,Western Blot检测E-cadherin、Fibronectin、α-SMA蛋白表达水平。Ketamine(5 to 125μg/mL)刺激细胞不同时间,ELISA检测上清液TGF-β1水平变化。SB505124阻断TGF-β1信号通路,Western Blot检测ketamine对EMT的诱导作用。荧光定量PCR法检测TGF-β1下游信号分子(Tβ-R1,Tβ-R2,Snail,Slug,Twist)。
结果1.大鼠经过16周ketamine暴露后,24小时饮水量和尿量在control组、LK组、HK组间无明显差异。LK组和HK组6小时排尿次数较对照组显著增多,HK组更为明显。尿动力学结果显示,长期滥用ketamine后,大鼠的排尿频率、逼尿肌无抑制收缩次数、膀胱压力均明显升高,而膀胱容量和膀胱顺应性明显降低,且随接ketamine剂量的增加而更加严重。HE染色结果显示:与control组相比,LK组、HK组上皮层明显变薄甚至全层缺失形成溃疡,黏膜下见不同程度的血管扩张。
参考文献
[1]Ketamine Increases Permeability and Alters Epithelial Phenotype of Renal Distal Tubular Cells via a GSK‐3β‐Dependent Mechanism[J].Hsin‐Yi Shyu,Chun‐Jung Ko,Yu‐Chen Luo,Hsin‐Ying Lin,Shang‐Ru Wu,Shao‐Wei Lan,Tai‐Shan Cheng,Shih‐Hsiung Hu,Ming‐Shyue Lee.J.Cell.Biochem..2016(4)
[2]Urocortin Attenuates TGFβ1‐Induced Snail1 and Slug Expressions:Inhibitory Role of Smad7 in Smad2/3 Signaling in Breast Cancer Cells[J].Lai Jin,Chao Zhu,Xiaofei Wang,Chuanhua Li,Chunxuan Cao,Jie Yuan,Shengnan Li.J.Cell.Biochem..2015(11)
[3]Possible pathophysiology of ketamine‐related cystitis and associated treatment strategies[J].Jia‐Fong Jhang,Yung‐Hsiang Hsu,Hann‐Chorng Kuo.Int.J.Urol..2015(9)
[4]Long-term ketamine abuse induces cystitis in rats by impairing the bladder epithelial barrier[J].Di Gu,Jun Huang,Youle Yin,Zhengfei Shan,Shaobin Zheng,Peng Wu.Molecular Biology Reports.2014(11)
[5]TGF-β1 induces EMT reprogramming of porcine bladder urothelial cells into collagen producing fibroblasts-like cells in a Smad2/Smad3-dependent manner[J].Syed S.Islam,Reza Bayat Mokhtari,Yaser El Hout,M.A.Azadi,M.Alauddin,Herman Yeger,Walid A.Farhat.Journal of Cell Communication and Signaling.2014(1)
[6]Cardiac matrix:A clue for future therapy[J].Paras Kumar Mishra,Srikanth Givvimani,Vishalakshi Chavali,Suresh C.Tyagi.BBA-Molecular Basis of Disease.2013(12)
[7]Increased apoptosis and suburothelial inflammation in patients with ketamine‐related cystitis:a comparison with non‐ulcerative interstitial cystitis and controls[J].Cheng‐Ling Lee,Yuan‐Hong Jiang,Hann‐Chorng Kuo.BJU Int.2013(8)
[8]王俊鹏.氯胺酮性膀胱纤维化中TGF-β1调控膀胱上皮细胞EMT的实验研究[D].南方医科大学,2017.
欢迎您浏览更多关于大鼠膀胱成纤维细胞的相关新闻资讯信息