大鼠骨骼肌卫星细胞的获取与培养
发布日期:2020/10/18 17:56:53
背景及概述[1]
卫星细胞是一种神经胶质细胞。分布于周围神经系统的神经胶质有两种,一称Schwann细胞,亦名神经膜细胞,另一种即为卫星细胞。后者位于神经细胞胞体的周围,为扁平或立方形,可能有保护和营养神经元的作用。骨骼肌卫星细胞是骨骼肌中位于细胞膜和肌膜之间的具有增殖分化潜力的肌源性干细胞,负责骨骼肌的生长和损伤修复。近年来,国外有报道将肌卫星细胞移植到冻伤的骨骼肌中,可改善肌肉功能。另外,骨骼肌可能会通过分泌低分子量细胞因子即骨骼肌源性抑瘤物显著抑制肿瘤细胞生长。有研究探讨体外培养的大鼠骨骼肌卫星细胞的分离纯化、原代与传代的培养方法,在细胞的培养过程中改变培养条件对其生长与分化的影响;以及随时间的推移,骨骼肌细胞的生长与分化特征,为将来进行骨骼肌干细胞临床应用,治疗心肌梗死及防治肿瘤奠定基础。
获取与培养[2]
1.取材。将新生大鼠拉颈椎处死,再用碘酒和乙醇消毒腿部,将新生鼠放入超净工作台后,取腿部肌肉置于平皿中。用Hank's液洗涤3次,并剔除脂肪、结缔组织、血液等杂物。用手术剪将肌肉剪成小块(1mm3),转移至离心管中,再用Hank's液洗3次,静置1min后弃去上层液体及漂浮组织。
2.组织块培养法。将剪碎的肌肉碎片转移到培养瓶(经L-多聚赖氨酸包被的培养瓶与未包被的各半,以形成对照组)内,贴附于瓶底面。翻转瓶底朝上,将培养液加至瓶中,培养液勿接触组织块。放入37℃、5%CO2培养箱静置3~5h,轻轻翻转培养瓶,使组织块浸入培养瓶中(勿使组织块漂浮),继续培养。3d后换液,以后每天换液1次。
3.细胞培养法。向上述离心管中加入0.25%的胰蛋白酶,置于37℃水浴锅中消化20min,每隔5min摇动1次离心管,或用吸管吹打1次,使细胞分离。然后加入生长培养基终止消化。反复吹打后,依次滤过100、200、400目的筛网,滤液收集后,1000r/min离心10min,弃上清,用生长培养基重新悬浮细胞,将细胞悬液加入未经L-多聚赖氨酸包被的培养瓶中,采用差速贴壁法去除成纤维细胞,37℃培养1h后移至经L-多聚赖氨酸包被的培养瓶内用生长培养基进行培养,4d后换液,以后每天换液1次。倒置显微镜下观察细胞的生长情况。
4.细胞的传代培养待培养瓶内的细胞达到一定密度后,将培养瓶中原来的培养液弃去,用0.25%胰酶溶液消化10~30s,加入生长培养基终止消化,用吸管反复吹打瓶壁上的细胞,使其完全脱落,以1∶1的比例传代,每天换液1次。倒置显微镜下观察细胞的生长情况。
5.分化培养基诱导分化取培养至第2代的细胞,消化后加入生长培养基进行培养,待细胞分裂、增殖至80%汇合后,改用分化培养基(含2%小牛血清的培养基)继续培养,倒置显微镜下观察细胞生长及分化情况[10-11]。
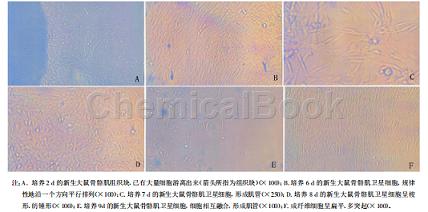
6.骨骼肌卫星细胞的鉴定将细胞培养液内小牛血清浓度降至2%,3~4d后细胞相互融合成肌管,肌管为光滑长条形。虽然卫星细胞的形态与成纤维细胞极为相似,但在镜下仍显示出有较大的差别。成纤维细胞的形态呈扁平、多突起的,而卫星细胞早期则以梭形、纺锤形为主,相互之间以细丝拉网,随培养时间的延长,细胞增殖、相互融合并逐渐规律性地沿一个方向平行排列,并形成多核的肌管。传代后2h就开始贴壁。倒置显微镜下观察到分离纯化的大鼠骨骼肌卫星细胞为圆形,折光性强,24h后开始贴壁,96h后完全贴壁,细胞呈梭形或纺锤形,中间夹杂少量未过滤掉的纤维碎片,细胞生长缓慢。随细胞密度的增加,细胞逐渐有规律地平行排列(图1-B)。当细胞融合到一定程度之后,不需要加分化培养基也可自发性地相互融合,形成肌管(图1-E)。待细胞密度达到70%~80%时,进行传代培养,发现室温下20s消化结果,1∶1接种于培养瓶中,传代细胞30min后开始贴壁,24h内贴壁完全,增殖速度也比原代快。传至第2代的细胞培养2d,待其完全贴壁后,采用分化培养基诱导分化。
主要参考资料
[1] 协和医学词典
[2] 大鼠骨骼肌卫星细胞培养的研究
欢迎您浏览更多关于大鼠骨骼肌卫星细胞的相关新闻资讯信息