纯碱的应用和制备
发布日期:2019/6/3 13:17:37
背景及概述[1]
纯碱又称苏打或碱灰。学名碳酸钠。白色粉末或细粒。人工合成纯碱始于18世纪末,法国N.路布兰发明了路布兰法。19世纪60~70年代,比利时E.索尔维用食盐、氨和二氧化碳制得纯碱,称索尔维法或氨碱法,并取代了路布兰法,从此成为制取纯碱的主要方法。1937年中国侯德榜在索尔维法基础上开发了侯氏制碱法(现称联合制碱法),可以同时制得纯碱和氯化铵。1952年在大连化学厂建立了中试车间,1964年正式建成联合制碱工业装置。纯碱还有另一重要来源,即用天然碱加工制取。美国是天然碱制纯碱的主要国家,1999年由天然碱制得的纯碱达1113.5万t,占总产量90%以上,中国和俄罗斯也有生产。20世纪90年代末,世界生产纯碱3700万t,中国2000年共产纯碱825万t(其中天然碱18.4万t)。世界纯碱消耗量,玻璃工业占50%,化学品占15%~18%,肥皂及洗涤剂占10%,造纸、水处理、食用等占20%。
性质[2]
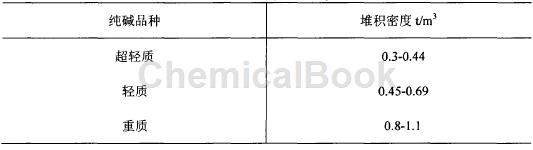
纯碱一般为白色粉末,在空气中为含十个结晶水的无色晶体,但结晶水不稳定,高温下会成为白色粉末状,成为强电解质,具有热稳定性,易溶于水,在35℃下可达到饱和溶解度,随温度提高溶解度不再增加,纯碱的水溶液呈碱性。碳酸纳是弱酸强碱盐,称它为"纯碱"的原因是因为实验室中用化学方法制出的碳酸钢比天然碱要纯净,在目前我国生产的工业产品中,纯碱的纯度一般为98%-99%么间,根据纯碱的堆积密度进行分类如表。
应用[2-3]
纯碱最常用于基本化工原料。在工业上用途广泛,需求量大,在制备其他种类的碱类或者无机盐等化工常用产品过程中,纯碱是最为常见的原料,例如:
1)制备烧碱可采用石灰苛化法,所用的主要原料即方纯碱、重碱等,主要过程是通过石灰苛化法,即利用氨氧化巧与纯碱进行复分解反应,制得烧碱,整体工艺节约资源,方便操作,所得产品质量较高,适用于间歇反应的小范围工业生产;
2)碳酸化法可用来制取重碱(小苏打),小苏打作为日常生活中常见的日用品,同时也作为制备纯碱过程中的中间产物,其纯度直接影响最终得到的纯碱产物,在我国工业中,利用纯碱碳酸化制备小苏打十分常见,主要是向纯碱溶液中通入二氧化碳得到碳酸氨钢,其作为微溶物会发生沉淀,工艺流程十分简单;
3)泡花碱(硅酸钠)在制备过程中也要纯碱与珪砂为原料,使两者在烙融条件下发生反应,得到产物泡花碱,其用途十分广泛,在国民工业体系中各部分都有所体现,比如泡花碱在化工系统中可用于制备各种硅酸钠类产品,是珪化合物的基本原料,在轻工业中是洗衣粉、肥皂等洗涂剂不可缺少的原料,在纺织工业中可用于漂白、助染或者浆洗等,除此之外在建筑、机械行业中也被广泛应用于粘合剂、耐火材料等,其制备方法主要是通过将纯碱与珪砂在烙融状态下混合反应,再加入水进行溶解过滤,工艺易于操作,产量较大;在我国工业体系中,除上主要用途外,纯碱在工业中也可作为中间原料制备各种含钢盛类,同时可W作为辅料用作生产其他化工产品上,用途十分广泛。因此,是衡量国家工业水平的重要指标,在一定程度上标志着一个国家的工业水平。近年来,由于可降解塑料的发明,塑料制品越来越多,同时国家对于废旧玻璃制品循环利用的为度加大,玻璃制品需求渐渐降低,逐渐被塑料制品取代,因此纯碱在玻璃工业中的用量逐渐下降。但由于在发展中国家中如我国,纯碱仍然占有十分重要的地位。另外纯碱的广泛用途也决定了其在工业体系中的重要地位,就全球工业发展而言,纯碱需求量依旧会维持在较高水平,未来还会缓慢增长。
制备[2-3]
1. 化学合成法:是国际上目前主要用到的制备纯碱方法。但在此之前,国际上有很多其他化学合成纯碱的方法,例如法国医生路布兰利用食盐为原料,制得了纯碱,获得专利,因此这种方法被称为路布兰制碱法。工艺原理如下所示:
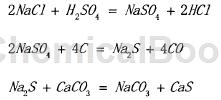
这种方法被称之为路布兰制碱法,可从化学反应方程式中看出,整体工艺所需条件较为苛刻,同时所产生的废料、废气都难再进行利用,因此这种方法并没能在国际上被广泛应用。
2. 联合制碱法:包括两个过程:个单元与氨碱法类似,主要是向饱和食盐水中持续通入氨气,W此得到氨盐水,再将二氧化碳气体通入到其中,此时可得到微溶物碳酸氨钢沉淀,经过滤、洗涂后可得到叛酸氨钻微小晶体,此时将所得中间产物碳酸氨钢再送入般烧炉中锻烧制得纯碱产品。除去碳酸氨钥沉淀的澄清滤液中含有大量的氯化钱和少量氯化钢,需要对其进行处理,这部分即为第二单元,主要是通过处理使氯化镑晶体能够从澄清滤液中析出。根据两种物质在水中的溶解度曲线,氯化按与氯化纳的溶解度随温度变化趋势差别较大,因此通过浓缩冷凝,可W将氯化倭副产物析出。送种方法可实现循环制碱,大幅度提高了制碱效率,同时还克服了索尔维制碱法的缺点,在国际上受到了很大程度的认可。但是后期在处理氯化较分离过程中仍存在较大问题,难W妥善解决循环过程中母液的回收利用,同时氯化钱的纯度很难得到保证,废液也存在较大的污染,这些缺点极大地限制了送种工艺的发展。
3.复分解法
1)复分解法制备纯碱的研究进展
通过对碳酸氨按和氯化纳复分解法制碱的研究后得出此方法不能同时制得两种纯产品,凡是用复分解法合成盐类,如欲得出两种纯产品盐,从相图上看,必须具各下面两个条件:从复分解相围上分析来说,两种原料盐应该是相对不稳定的一对反应物,可完全进行反应后得到纯产物,而所得两种产物应为两种相对稳定的盐类。选取碳酸氨钱和氯化纳作为反应的原料,进行复分解反应时候,这两种原料是符合上述要求,满足条件的。需要采用一高一低两种温度来同时制得两种产品,通过相图分析,当处于这两种温度的时候,所选用的不稳定盐的溶解度相图需要有较大幅度变化。这样有利于在高温时单独析出一种产品;而另一种产品可在低温时轻易析出。对于复分解制取纯碱和氯化按的Na+,NH4+/HCO32-,Cr加到50℃的时候,从相图上可看出,氯化较和碳酸氨钢的相区的界线位置基本不会改变,另外在高温相区和低温相区,两物质的相界线出现了交叠。送就使得同时制取两种纯产品盐的发生相对比较困难。
2)中间盐法
利用硫酸中间盐法在福建省永安合成氨厂建了复分解法制碱装置,该法是在析出碳酸氨钢后的母液中加入浓硫酸,去除母液中HCO3-,可防止在析出氯化钱的过程中碳酸氨纳的析出。但加浓硫酸时,由于浓硫酸加入后大量放热,造成烟雾大量出现,环境较差。
3)常温结晶法
在硫酸中间盐或硝酸中间盐法基础上对常温结晶法进行改进,直接像母液中添加中间盐,使得氯化镑能够直接析出。在工艺中省去浓缩后冷析的工艺段,工艺流程简化,节约成本,提高了复分解法制备纯碱的竞争力。
4)其他工艺改良办法
常用的生产方法,可用来降低现在纯碱行业中制备纯碱时其中所含的盐分,种可采用重碱离屯、机再度对过滤所得碳酸氨纳沉淀进行二次脱水工艺,第二种是对滤碱机水洗装置的改造,第三种是对水洗过程的改进即加入更多水洗步骤,这种措施原理都是通过增加水洗过程的能效来去碳酸氨钢沉淀中所含的盐组分,使最终所得纯碱产品中杂质盐分小于0.4%。
主要参考资料
[1] 百科知识数据辞典
[2] 工业废盐制备纯碱工艺的开发
[3] 近几年我国纯碱生产技术的进展及发展前景
欢迎您浏览更多关于碳酸钠的相关新闻资讯信息
- 纯碱是什么?它的生产工艺是怎样的? 2024/08/27
- 碳酸钠的俗称是什么?有什么用途? 2024/04/16
- 碳酸钠在洗涤剂中的应用 2023/05/12
- 无水碳酸钠的制备 2022/07/08
- 碳酸钠的制取与应用 2021/07/13
- 碳酸钠和碳酸氢钠对比 2021/05/25
- 纯碱期货价格行情 2021/05/08
- 2021年国内纯碱行业供需格局展望 2021/02/24
- 化学界三父子:苏打、小苏打和大苏打,各有什么本领? 2021/02/24
- 碳酸钠的作用与用途 2020/11/06
1of4



