53BP1抗体的应用
发布日期:2024/5/15 9:09:55
背景[1-3]
53BP1抗体是一种针对53BP1(Tumor Protein P53 Binding Protein 1)蛋白的特异性抗体。53BP1蛋白在DNA损伤反应中扮演重要角色,包括促进DNA损伤后的检查点信号传导、充当将DNA损伤反应蛋白募集到受损染色质的支架,以及通过限制双链断裂后的末端切除来促进NHEJ(非同源末端连接)通路等。
这种抗体通常用于研究53BP1蛋白在细胞和组织中的表达情况,以及53BP1蛋白与其他蛋白的相互作用。通过免疫组织化学(IHC)、免疫细胞化学(ICC/IF)、免疫印迹(WB)和流式细胞术(FC)等实验方法,可以检测和分析53BP1蛋白的定位、表达和功能。
此外,最近的研究还发现53BP1在调节DNA结构方面也具有一定的生物学功能,特别是在异染色质的高度致密区域。53BP1会在染色质区域积聚并形成小液滴,从而帮助维持基因组稳定性。这些发现进一步揭示了53BP1蛋白在细胞生物学和疾病发生中的重要作用。
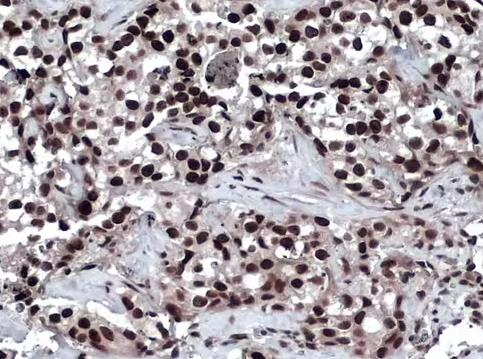
53BP1抗体
使用53BP1抗体(或其他任何抗体)进行实验时,通常需要遵循一系列标准的步骤,这些步骤可能因实验的具体要求和所使用的检测方法(如免疫荧光、免疫印迹、流式细胞术等)而有所不同。以下是一个基于免疫荧光技术(用于细胞和组织切片)的53BP1抗体使用步骤的概述
1.样品准备:
对于细胞,首先进行细胞培养、固定(通常使用4%多聚甲醛)和通透(如使用0.1%Triton X-100)。
对于组织切片,首先进行切片、固定和通透处理。
2.封闭:
使用封闭液(如含有1-5%正常血清的PBS)封闭样品,以减少非特异性结合。
3.一抗孵育:
稀释53BP1抗体至适当的浓度(根据供应商的建议和预实验确定)。
将稀释后的一抗溶液滴加到样品上,并在湿盒中于4°C孵育过夜或在室温下孵育1-2小时。
4.洗涤:
使用PBS或TBS缓冲液洗涤样品,以去除未结合的一抗。
5.二抗孵育:
选择与一抗种属特异性匹配的荧光标记二抗(如山羊抗兔IgG,偶联荧光染料如Alexa Fluor 488)。
稀释二抗至适当浓度,并滴加到样品上,在室温下孵育30分钟至1小时。
6.再次洗涤:
使用PBS或TBS缓冲液再次洗涤样品,以去除未结合的二抗。
7.细胞核染色(可选):
使用DAPI(4',6-二脒基-2-苯基吲哚)或其他荧光染料对细胞核进行染色。
8.封片:
将样品封在抗荧光淬灭封片剂中,并使用盖玻片封片。
9.观察:
使用荧光显微镜或共聚焦显微镜观察样品,并捕获图
应用[4][5]
53BP1抗体可以用于长链非编码RNA SCARNA2介导的DNA损伤修复在结直肠癌放疗敏感性中的作用及机制
Lnc RNA SCARNA2在DNA损伤修复中的作用探讨1、RIP-seq筛选ATR结合的lnc RNA首先选用ATR抗体通过RNA免疫共沉淀方法(RNA Binding Protein Immunoprecipitation,RIP)富集与ATR结合的RNA,通过高通量二代测序筛选与ATR结合的lnc RNA,选取排名前30位的lnc RNA,然后通过RIP和RT-PCR的方法验证它们与ATR的相互作用关系,发现SCARNA2与ATR的结合丰度最高,因此将目标靶分子确定为SCARNA2。通过探究SCARNA2在15种细胞系的基础表达量,确定研究细胞系为结肠癌细胞系HCT116和HT29。2、DNA损伤对SCARNA2表达水平的影响将HCT116和HT29细胞经电离辐射(Ionizing radiation,IR)、DNA损伤诱导剂喜树碱(Camptothecin,CPT)或依托泊苷(Etoposide,ETO)处理后,在不同时间点分别提取细胞的RNA,经反转录和RT-PCR检测SCARNA2转录水平的变化。将HCT116和HT29细胞分别与DDR通路抑制剂(DNA-PKcs抑制剂Nu7441、ATM抑制剂Ku-55933、ATR抑制剂VE-821)孵育后,再分别用IR、CPT或ETO处理细胞后,在SCARNA2响应DNA损伤最明显的时间点提取RNA,RT-PCR检测DDR通路抑制剂对SCARNA2转录水平的影响。3、SCARNA2对DNA损伤修复通路的影响通过慢病毒包装质粒系统构建SCARNA2敲低(sh-SCARNA2)、CRISPR Cas9敲除(sg-SCARNA2)和过表达(SCARNA2-OE)稳转细胞系,通过RT-PCR测定下调和过表达效率。通过彗星电泳检测SCARNA2下调细胞照后的DNA损伤程度;通过53BP1抗体免疫荧光的方法检测SCARNA2干扰细胞在照后0、0.5、4、8、12和24 h形成γH2AX和53BP1 foci的动态变化情况。最后通过蛋白凝胶电泳(Western Blot,WB)的方法检测SCARNA2下调细胞经IR、CPT或ETO处理后,DDR通路相关蛋白分子的表达水平变化情况。
参考文献
[1]When the chains do not break:the role of USP10 in physiology and pathology[J].Bhattacharya Udayan;Neizer Ashun Fiifi;Mukherjee Priyabrata;Bhattacharya Resham.Cell Death&Disease,2020
[2]The Role of Non-Coding RNAs in Controlling Cell Cycle Related Proteins in Cancer Cells[J].Ghafouri Fard Soudeh;Shoorei Hamed;Anamag Farhad Tondro;Taheri Mohammad.Frontiers in Oncology,2020
[3]RNA in cancer[J].Goodall Gregory J.;Wickramasinghe Vihandha O..Nature Reviews Cancer,2020
[4]Biomarkers in Colorectal Cancer:Current Research and Future Prospects[J].Olorunseun O.Ogunwobi;;Fahad Mahmood;;Akinfemi Akingboye.International Journal of Molecular Sciences,2020
[5]陈媛媛.长链非编码RNA SCARNA2介导的DNA损伤修复在结直肠癌放疗敏感性中的作用及机制[D].中国人民解放军海军军医大学,2022.
欢迎您浏览更多关于53BP1抗体的相关新闻资讯信息