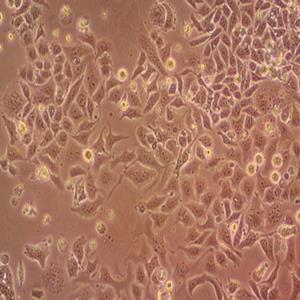
人胎盘绒膜癌细胞的应用
发布日期:2023/4/7 8:40:11
背景[1-3]
人胎盘绒膜癌细胞取自人绒癌脑转移组织,在仓鼠颊囊移植传代8年。利用移植瘤组织进行体外培养,建立细胞系。利用不同传代方法建立了不同亚系,JEG-3是其衍生克隆。Bewo细胞可以产生雌激素、孕激素、雌酮、雌二醇、雌三醇、hCG、胎盘催乳素、角蛋白。
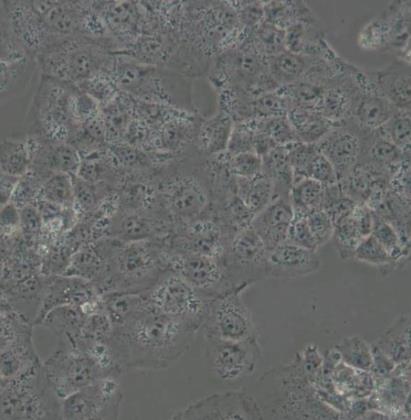
人胎盘绒膜癌细胞
人胎盘绒膜癌细胞培养操作规程
一.培养基及培养冻存条件准备:
1)准备1640培养基;优质胎牛血清,10%;双抗,1%。
2)培养条件:气相:空气,95%;二氧化碳,5%。温度:37℃,培养箱湿度为70%-80%。
3)冻存液:90%血清,10%DMSO,现用现配。
二.细胞处理:
1)复苏细胞:将含有1mL细胞悬液的冻存管迅速放入37℃水浴中(水面要低于冻存管盖部)摇晃解冻,移入事先准备好的含有4mL培养基的15ml离心管中混合均匀。在1000RPM条件下离心4分钟,弃去上清液,加入1mL培养基后吹匀。然后将所有细胞悬液移入含有5ml培养基的培养瓶中培养过夜。第二天换液并检查细胞密度。
2)细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
将细胞悬液按1:2到1:5比例分到新皿中或者瓶中,补加培养基至6ml,放入培养箱继续培养。次传代推荐传代密度为1:2。
3)细胞冻存:待细胞生长状态良好时,可进行细胞冻存。
下面T25瓶为例;
1,细胞冻存时,取上清,可使用血球计数板计数。
2,4min,1000rpm离心去掉上清。加1ml血清重悬细胞,根据细胞数量加入血清和DMSO,轻轻混匀,DMSO终浓度为10%,细胞密度1-2xE6/ml,每支冻存管冻存1ml细胞悬液,注意冻存管做好标识。
3,将冻存管置于程序降温盒中,放入-80度冰箱,至少2个小时以后转氮入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4][5]
人胎盘绒膜癌细胞可以用于MSX2对人胎盘滋养层细胞侵袭能力的影响及机理研究
以不同时期人胎盘绒毛组织及人滋养层细胞系作为研究对象,研究MSX2对人胎盘滋养层细胞侵袭行为的影响及其机制。
方法:1.用免疫组织化学方法检测MSX2在不同时期的人胎盘绒毛滋养层细胞的表达。
2. 用Western Blotting方法检测MSX2在HTR8/SVneo,JEG-3,JAR和BeWo四种人滋养层细胞中的表达。
3. 对人正常滋养层细胞系HTR8/SVneo转染MSX2过表达质粒或特异性的MSX2-si RNA后,运用细胞侵袭实验(Matrigel invasion assay)检测MSX2对滋养层细胞侵袭能力的影响,随后收集上清液和细胞,分别用明胶酶谱法和Western Blotting方法检测基质金属蛋白酶Pro-MMP-2,-9和MMP-2,-9的表达。
4. 在正常滋养层细胞系HTR8/SVneo及绒毛膜癌细胞系JEG-3中过表达或干扰MSX2后,收集细胞RNA或者蛋白,用qRT-PCR和(或)Western Blotting方法检测与EMT及侵袭相关因子E-cadherin,vimentin和β-catenin的表达。
5. 用免疫组织化学及Western Blotting方法对比检测MSX2在人正常足月胎盘和先兆子痫胎盘滋养层细胞中的表达。
结果:1.MSX2蛋白表达在整个妊娠时期人胎盘的细胞滋养层,合胞体滋养层和绒毛外滋养层细胞中,且在HTR8/SVneo,JEG-3,JAR和BeWo四种人滋养层细胞中也均有表达。
2. HTR8/SVneo细胞转染MSX2过表达质粒后,该细胞在体外的侵袭能力得到了提升(271±45vs.443±75,P<0.05),并且伴随着基质金属酶-2(MMP-2),vimentin和β-catenin的表达升高(P<0.05)。转染MSX2-siRNA后,结果与之相反。然而,不管是转染MSX2过表达质粒还是MSX2-siRNA,都只影响β-catenin的蛋白水平,而不影响其mRNA水平。同时,在JEG-3细胞中过表达MSX2,导致E-cadherin的表达降低(P<0.05),而转染MSX2-si RNA,导致E-cadherin的表达升高(P<0.05)。
3.在人先兆子痫胎盘绒毛中,MSX2的蛋白表达水平比正常足月胎盘显著降低(P<0.05)。结论:MSX2能增强人滋养细胞的侵袭能力,其可能机制是通过激活经典Wnt信号进而促进EMT,且MSX2表达的异常可能与先兆子痫的发生相关。
参考文献
[1]Biphasic effects of FGF2 on odontoblast differentiation involve changes in the BMP and Wnt signaling pathways[J].Sagomonyants;;Mina.Connective Tissue Research,2014(sup1)
[2]BMP4 Promotes EMT and Mesodermal Commitment in Human Embryonic Stem Cells via SLUG and MSX2[J].Anne Richter;;Lena Valdimarsdottir;;Helga Eyja Hrafnkelsdottir;;Johann Frimann Runarsson;;Arna Run Omarsdottir;;Dorien Ward‐van Oostwaard;;Christine Mummery;;Gudrun Valdimarsdottir.Stem Cells,2014(3)
[3]Conditional Deletion of MSX Homeobox Genes in the Uterus Inhibits Blastocyst Implantation by Altering Uterine Receptivity[J].Takiko Daikoku;;Jeeyeon Cha;;Xiaofei Sun;;Susanne Tranguch;;Huirong Xie;;Tomoko Fujita;;Yasushi Hirota;;John Lydon;;Francesco DeMayo;;Robert Maxson;;Sudhansu K.Dey.Developmental Cell,2011(6)
[4]Msx1 and Dlx5 function synergistically to regulate frontal bone development[J].Il‐HyukChung;JunHan;JunichiIwata;YangChai.Genesis,2010(11)
[5]梁浩.MSX2对人胎盘滋养层细胞侵袭能力的影响及机理研究[D].重庆医科大学,2016.
欢迎您浏览更多关于人胎盘绒膜癌细胞的相关新闻资讯信息