FDA批准特利加压素用于肝肾综合征
发布日期:2023/4/3 11:11:42
晚期肝病患者由于有效循环血容量不足,肾脏血流量下降,内毒素血症,以及前列腺素减少等因素,可发生肝肾综合征(HRS),且与腹水显著相关。目前,HRS存活率较低,除肝肾移植外,尚无有效的干预手段。
2022年9月14日,特利加压素被FDA批准用于HRS,这是首个被批准用于治疗HRS的药物。此次获批与之前的一项随机双盲研究结果密切相关。本文将对该研究进行介绍,以飨读者。
研究设计
CONFIRM研究是在2016年7月13日~2019年7月24日期间开展的一项3期、多中心、多国(美国和加拿大)的随机双盲研究。
研究的纳入标准为①肝硬化和存在腹水;②肾功能快速恶化,其定义为血清肌酐水平>2.25mg/dL,并在2周内血肌酐水平翻倍;③停用利尿剂后,血浆容量扩大伴白蛋白,并且48小时内肾功能无改善(血肌酐下降20%或<2.25mg/dL);④若患者条件允许,则在随机分组前应用米多君或奥曲肽;⑤患者年龄≥18岁。
研究的主要排除标准是①血清肌酐水平>7.0mg/dL;②在随机分组后的2天内,进行了至少1次大容量(4L)穿刺;③脓毒症和/或失控的细菌感染;④休克;⑤使用/暴露于肾毒性药物;⑥蛋白尿>500mg/d;⑦血尿或镜下血尿;⑧妊娠;⑨在4周内接受肾脏替代治疗(RRT)等。
纳入研究的患者分为2组,特利加压素组的患者注射特利加压素(0.85mg),对照组注射安慰剂(生理盐水),2组患者每6h接受1次注射。
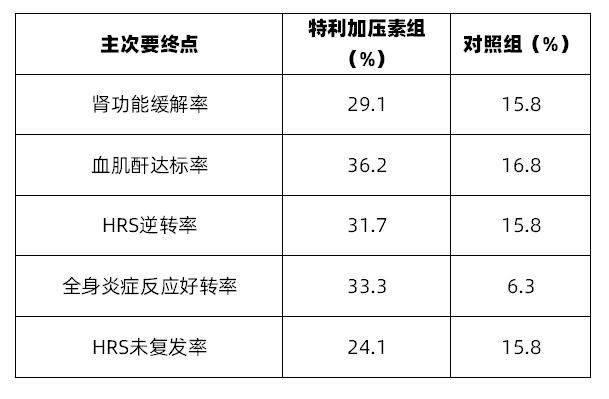
主要终点:HRS患者肾功能缓解率,其定义为连续2次血肌酐水平≤1.5mg/dL,其间隔时间至少2h,采样时间至少在给药24h后进行。次要终点为①血肌酐达标率:14d或出院后,患者血肌酐水平≤1.5mg/dL;②HRS逆转率:定义为30d后,患者不使用RRT;③全身炎症反应好转率:其定义为14d或出院后,患者全身炎症反应综合征(SIRS)是否好转;④HRS未复发率:15d或出院后证实HRS以出现恢复,且30d时患者未复发。
研究结果
共计纳入300例患者,其平均年龄(SD)为53.8(11.49),男性占比59.7%。特利加压素组在肾功能缓解率、血肌酐达标率、HRS逆转率、全身炎症反应好转率以及HRS未复发率方面优于对照组(表1)。
表1 CONFIRM的研究结果
基于该研究结果,特利加压素在美国的药品说明书进行了更新。在更新后的特利加压素说明书中,特利加压素适用于肾功能快速下降的HRS患者,但对于血肌酐水平>5mg/dL的患者,特利加压素带来的获益受限。说明书中建议特利加压素的起始剂量为0.85mg/次,6h注射1次。第1~3d时,每次静注时间应>2min。第4d后,使用剂量应根据血清肌酐水平调整剂量。
此外,特利加压素可能增加严重或致命的呼吸衰竭,血氧含量低的患者不推荐使用,且治疗期间建议进行血氧监测。由于特利加压素治疗可能导致部分组织缺血,因此可能会使患者不适合进行肝肾移植。妊娠期间使用该药可能对胎儿造成损害,有生育计划的妇女应谨慎考虑。
参考文献:
1.FDA Announcement.FDA approves treatment to improve kidney function in adults with hepatorenal syndrome. Link:https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-treatment-improve-kidney-function-adults-hepatorenal-syndrome
2.Clinical Trails.gov. Study To Confirm Efficacy and Safety of Terlipressin in Hepatorenal Syndrome (HRS) Type 1. Link:https://www.clinicaltrials.gov/ct2/show/NCT02770716
3. FDA approved. Terlipressin Label and Prescribing Information. Link:https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/022231s000lbl.pdf
欢迎您浏览更多关于乙二胺封端的聚乙烯亚胺的相关新闻资讯信息



