(R)-1-BOC-3-羟甲基吡咯烷的合成及其应用
发布日期:2022/11/30 14:59:08
简介
已有研究表明,在体内和体外实验中,(R)-1-BOC-3-羟甲基吡咯烷对哺乳动物细胞和组织无细胞毒性且不会引起炎症反应[1]。此外,通过调控掺杂阴离子和聚合物的氧化态,(R)-1-BOC-3-羟甲基吡咯烷对蛋白质吸附和构象产生影响,从而影响细胞形态和增殖。而且研究表明采用(R)-1-BOC-3-羟甲基吡咯烷与亲水性丙烯酸酯基水凝胶形成导电水凝胶可用于植入式生物传感器装置[2]。该导电水凝胶用作检测乳酸浓度的电化学传感器、检测和定量分析代谢物和生物标记物,对于护理医学、外科和重症监护室等有重要的研究意义[3]。
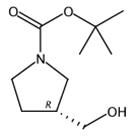
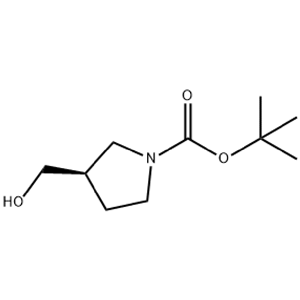
图1 (R)-1-BOC-3-羟甲基吡咯烷的结构式。
合成

图2 (R)-1-BOC-3-羟甲基吡咯烷的合成路线[4]。
在0°C下向(R)-1-(叔丁氧基羰基)吡咯烷-3-羧酸(1.21 g,5.6 mmol)在THF(30 mL)中的搅拌溶液中滴加硼烷THF(1.0 M,17 mL,16.9 mmol)。将所得混合物在30分钟内加热至室温,然后在45℃下加热1小时,然后在55℃下加热90分钟。然后将反应混合物冷却至0℃,并用3N HCl(30 mL)小心淬灭。将所得混合物在室温下搅拌20分钟,然后用Et2O(50mL)萃取。有机层用饱和NaHCO3(20mL)盐水(20ml)洗涤,用Na2SO4干燥,过滤并减压浓缩,得到(R)-1-BOC-3-羟甲基吡咯烷(1.1g,91%),呈无色油状。合成路线如图2所示。
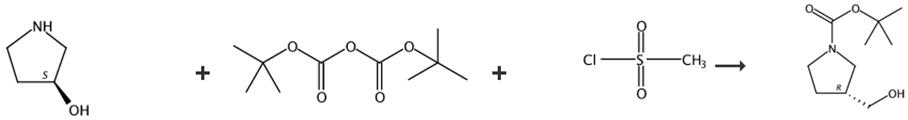
图3 (R)-1-BOC-3-羟甲基吡咯烷的合成路线[5]。
步骤1:将化合物(1.27g,4.79mmol)溶解在N,N-二甲基甲酰胺(15mL)中,并向其中加入氰化锂(0.47g,14.37mmol)。将混合物在80℃下搅拌16小时,冷却至室温,减压蒸馏除去溶剂,用乙酸乙酯稀释,用水和盐水洗涤。有机层用无水硫酸镁干燥,减压蒸馏,用己烷和乙酸乙酯的2:1混合溶剂通过柱色谱纯化,得到中间体1(0.66g,70%)。1HNMR(400MHz,CDCl3);δ3.67(1H,br s)、3.58(2H,br)、3.45(1H、br s),3.09(1H)、2.25(2H、m)、1.47(9H,s)
步骤2:将含有上述制备的中间体1的混合物在100℃下搅拌3小时。将混合物冷却至室温,减压蒸馏以除去溶剂,溶于甲醇(10mL),冷却至0℃。向其中加入氯三甲基硅烷(1.45 g,13.39 mmol),将混合物在室温下搅拌16小时,再次冷却至0℃,并向其中加入二异丙基乙胺(2.59 g,20.09 mmol)和二碳酸二叔丁酯(0.8 g,3.68 mmol)。将混合物在室温下搅拌16小时,减压蒸馏除去溶剂,用乙酸乙酯稀释,用水和盐水洗涤。有机层用无水硫酸镁干燥,减压蒸馏,用己烷和乙酸乙酯的3∶1混合溶剂通过柱色谱纯化,得到中间体2(0.66g,70%)。1H NMR(500MHz,CDCl3);δ3.71(3H,s)、3.67~3.40(3H)、3.34(1H,m)、3.04(1H,m),2.12(2H,br s)、1.45(9H,s)
步骤3:将上述得到的化合物中间体2(1.5 g,6.542 mmol)溶于40 mL四氢呋喃中,并冷却至0°C。向其中缓慢加入硼氢化锂2.0 M四氢呋喃溶液(6.54 mL,13.08 mmol),并在室温下进行反应16小时。反应溶液用1N盐酸溶液中和,减压蒸馏,用乙酸乙酯稀释,用水和盐水洗涤。有机层用无水硫酸镁干燥,得到标题化合物(R)-1-BOC-3-羟甲基吡咯烷(1.0g,76%)。1H NMR(400MHz,CDCl3);δ3.65(2H,br)、3.36-3.53(3H,br)。合成路线如图3所示。
应用
导电高分子水凝胶与(R)-1-BOC-3-羟甲基吡咯烷结合的新型水凝胶材料有望应用于心肌修复[6]。此种材料能模拟细胞外基质组分,调节细胞的粘附、增殖与分化;具备与心肌组织匹配的电学活性,可以促进细胞间电信号传递;还具备独特的力学、抗氧化、促成血管等,改善心肌细胞微环境[7]。基于这些优点,以(R)-1-BOC-3-羟甲基吡咯烷作为基质的导电高分子水凝胶是理想的心肌组织修复材料的选择之一。
参考文献
[1] G.M. Bacani, W. Chai, D.M. Chung, S.D. Goldberg, G. Hirst, V. Kaushik, E.V. Mercado-Marin, D. Raymond, M. Seierstad, R.C. Smith, T. Sundberg, M.S. Tichenor, J.D. Venable, J. Wei, R. Xavier, Heteroaromatics as small molecule inhibitors of salt inducible kinases and their preparation, Janssen Biotech, Inc., USA; The Broad Institute, Inc.; The General Hospital Corporation . 2022, p. 705pp.
[2] G.K. Kumi, A.V. Purandare, G. Li, W. Shan, J.A. Balog, E.C. Cherney, Y. Chen, Preparation of pyridinyl substituted oxoisoindoline compounds as Helios protein inhibitors useful for the treatment of cancer and viral infections, Bristol-Myers Squibb Company, USA . 2022, p. 215pp.
[3] J. Liang, A. Jakalian, M.J. Lambrecht, R. Larouche-Gauthier, M. Huestis, M.U. Ung, X. Wang, A. Yadav, J.R. Zbieg, F. Broccatelli, Preparation of indolin-1-one derivatives as Cbl-b inhibitors for treatment of cancer, Genentech, Inc., USA . 2022, p. 516pp.
[4] E. Perola, J.T. Close, M.J. Burke, J.D. Brubaker, T.A. Dineen, C.V. Miduturu, Preparation of 2-amino-7,8-dihydro-5H-pyrano[4,3-b]pyridin-5-one compounds as MAP4K1 inhibitors, Blueprint Medicines Corporation, USA . 2022, p. 215pp.
[5] F. Rancati, A. Accetta, A.M. Capelli, D. Pala, C. Edwards, A.E. Pasqua, P.B. Kapadnis, A.J.F.A. Cheguillaume, D.E. Clark, Preparation of dihydrofuropyridines as Rho-kinase inhibitors useful in treatment and prevention of Rho-kinase-mediated diseases, Chiesi Farmaceutici S.p.A., Italy . 2022, p. 100pp.
[6] K. Yang, J. Zhang, F. Cao, L. Li, Y. Song, Preparation method of five-membered heterocycle substituted benzamides and its application SphK2 inhibitors for treating cancers, Hebei University, Peop. Rep. China . 2022, p. 15pp.
[7] C. Yu, D. Zi, Y. Jia, Y. Li, T. Jia, Preparation method of polyhydroxylated pyrrolidine compound, and application thereof in preparation of medicines for preventing and treating various related diseases, Institute of Chemistry, Chinese Academy of Sciences, Peop. Rep. China . 2022, p. 30pp.
欢迎您浏览更多关于(R)-1-BOC-3-羟甲基吡咯烷的相关新闻资讯信息