3-氨基-4-碘吡啶的合成及其应用
发布日期:2022/11/24 13:20:35
简介
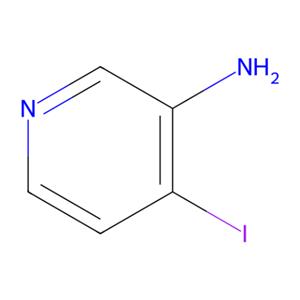
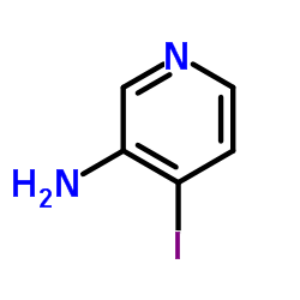
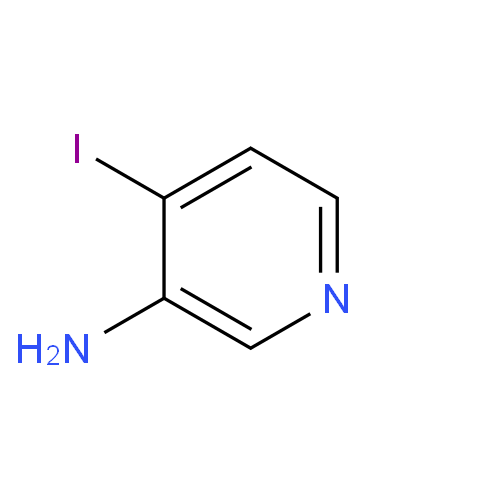
3-氨基-4-碘吡啶是众多吡啶衍生物中比较知名的中间体。因其具有良好的生物活性,常被用于合成医药和农药的重要原料或中间体,在吡啶类药物的合成上发挥着重要作用。因此,3-氨基-4-碘吡啶在药物合成中的应用将具有重要的参考价值和实际意义[1]。其结构式如图1所示。
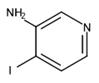
图1 3-氨基-4-碘吡啶的结构式。
合成
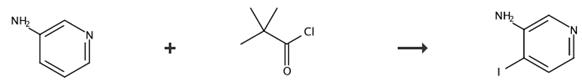
图2 3-氨基-4-碘吡啶的合成路线[2]。
步骤1:将2,2-二甲基-N-吡啶-3-基丙酰胺缓慢添加到吡啶-3-ylamine(20 g,212.49 mmol,CAS RN 462-08-8)的溶液中,该溶液为THF:Et2O(175 mL;2.5:1 v/v)的混合物,在0°C下缓慢添加新戊酰氯(26 mL,212.5 mmol,CAS RN 3282-30-2)的溶液,在THF(50 mL)和Et3N(44 mL,318.7 mmol)中,并在该温度下搅拌1小时。反应完成后,过滤反应混合物并真空蒸发滤液。用正己烷洗涤粗滤饼,得到标题化合物。无色结晶固体(32g,85%)。质谱(ESI):m/z=179.4[m+H]+。
步骤2:在25°C下,将N-(4-碘代吡啶-3-基)-2,2-二甲基丙酰胺添加到THF(50 mL)中的2,2-dimethyl-N-pyridin-3-基丙酰胺(7 g,39.32 mmol)溶液中TMEDA(20 mL,CAS RN 110-18-9)。将混合物冷却至-70°C,在氩气氛下30分钟内添加正丁基锂(66 mL,1.6M正己烷溶液,CAS RN 109-72-8)。将反应混合物在-15°C下搅拌1小时,然后在0°C下再搅拌1小时。将反应混合物再冷却至-70℃,然后在1小时内缓慢加入碘(29.2 g,115.1 mmoL)在THF(120 mL)中的溶液,并使所得混合物在25℃下搅拌16小时。将水和饱和Na2S2O3水溶液加入混合物中,然后用EtOAc萃取。合并的有机层用盐水洗涤,用无水Na2SO4干燥,过滤并真空浓缩,得到粗残留物,用硅胶柱色谱法(40%EtOAc在正己烷中)纯化,得到标题化合物。淡黄色固体(800 mg,37%)。质谱(ESI):m/z=305.4[m+H]+。
步骤3:将N-(4-碘代吡啶-3-基)-2,2-二甲基丙酰胺(6 g,19.73 mmol)在3M HCl水溶液(50 mL)中的溶液加热至100℃18小时。反应完成后,用EtOAc洗涤反应物质。在冷却下,使用固体Na2CO3将水层的pH调节至pH 9,并用EtOAc萃取水层。合并的有机层用盐水洗涤,用无水Na2SO4干燥,过滤并真空浓缩,得到4-碘代吡啶-3-基胺,该胺用于下一步,无需进一步纯化。棕色粘性固体3-氨基-4-碘吡啶(3.2克:,73%)。合成路线如图2所示。
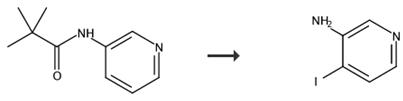
图3 3-氨基-4-碘吡啶的合成路线[3]。
1升三颈圆底烧瓶配有机械搅拌器、热电偶、氮气入口和干燥管,并置于加热套中。向烧瓶中加入N-(4-碘代(3-吡啶基))-2,2-二甲基丙酰胺(43,45克)和25%硫酸(270毫升)。原料在25%硫酸中的溶解度很高,形成淡黄色透明溶液。将反应混合物加热至80°C 8小时。将反应混合物在80°C下连续搅拌,直到认为完全。然后加入另外的乙酸乙酯(200mL),将反应物搅拌10分钟,并使各层分离。收集有机层,用乙酸乙酯(2×50mL)萃取水层。用MgSO4和木炭干燥合并的有机层,用玻璃纤维滤纸过滤,浓缩至干。残留物用MTBE(50mL)稀释,过滤固体,用MTBE(10mL)漂洗。将产物空气干燥2小时,然后在室温下在高真空下干燥至恒重。4-氯-3-吡啶胺(44,批号1358-86-1)为灰白色固体,合成产率为24g(75%)。使用HPLG(PLX-LG3,220)鉴定化合物为3-氨基-4-碘吡啶,其纯度为100%。合成路线如图3所示。
应用
3-氨基-4-碘吡啶是重要的工业原料,广泛应用于医药、农药、染料等行业。由于吡啶环具有生物活性,在合成药物方面具有其他基团或官能团不可替代的作用,因此在医药研究中是一个热点领域[4-5]。在医药领域,3-氨基-4-碘吡啶的衍生物是合成治疗十二指肠溃疡药泮托拉唑钠的重要中间体[6]。在染料领域,3-氨基-4-碘吡啶主要是作为合成偶氮化合物的偶合剂,4-硝基-2-氨基-1-羟基苯与2-氨基-3-羟基吡啶反应生成吡啶酮类染料[7]。综上所述,3-氨基-4-碘吡啶是重要的工业原料和医药中间体,其衍生物已经得到了广泛的应用。
参考文献
[1] D.J. Foley, S. Zinken, D. Corkery, L. Laraia, A. Pahl, Y.-W. Wu, H. Waldmann, Phenotyping Reveals Targets of a Pseudo-Natural-Product Autophagy Inhibitor, Angew. Chem., Int. Ed. 59(30) (2020) 12470-12476.
[2] Y. Makida, M. Saita, T. Kuramoto, K. Ishizuka, R. Kuwano, Asymmetric Hydrogenation of Azaindoles: Chemo- and Enantioselective Reduction of Fused Aromatic Ring Systems Consisting of Two Heteroarenes, Angew. Chem., Int. Ed. 55(39) (2016) 11859-11862.
[3] I.M. McDonald, A. Ng, J. Cutrone, R. Mate, R.E. Olson, Novel tricyclic diamines 1. Synthesis of 1,4-diazaisotwistane and 1,4-diazahomoisotwistane as constrained 3-aminoquinuclidine isosteres, Tetrahedron Lett. 59(8) (2018) 747-750.
[4] L.-l. Meng, H.-t. Cheng, D.-x. Xue, Q. Wang, J.-f. Bai, Synthesis and selective CO2 adsorption of a rtl-MOF based upon 5-(3-amino-pyridin-4-yl) -isophthalic acid and [Cu2(COO)4]-paddlewheel unit, Wuji Huaxue Xuebao 36(6) (2020) 1098-1104.
[5] T.T. Schempp, B.E. Daniels, S.T. Staben, C.E. Stivala, A General Strategy for the Construction of Functionalized Azaindolines via Domino Palladium-Catalyzed Heck Cyclization/Suzuki Coupling, Org. Lett. 19(13) (2017) 3616-3619.
[6] G. Szoke, A. Takacs, Z. Berente, A. Petz, L. Kollar, Synthesis of amino-substituted pyridylglyoxylamides via palladium-catalyzed aminocarbonylation, Tetrahedron 72(22) (2016) 3063-3067.
[7] Y. Wang, B.J. Peiffer, Q. Su, J.O. Liu, One-step Heck Reaction Generates Nonimmunosuppressive FK506 Analogs for Pharmacological BMP Activation, ACS Med. Chem. Lett. 10(9) (2019) 1279-1283.
欢迎您浏览更多关于3-氨基-4-碘吡啶的相关新闻资讯信息