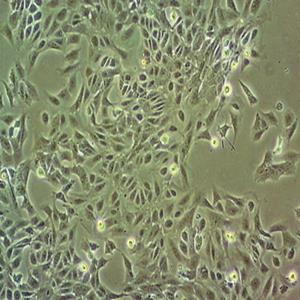
人肝癌细胞的应用
发布日期:2022/2/8 14:10:53
背景[1-3]
人肝癌细胞来源于一名15岁的白人少年的肝癌组织。该细胞表达甲胎蛋白、白蛋白、α-2-巨球蛋白、α-1-抗胰蛋白酶、转铁蛋白、α-1-抗凝乳蛋白酶、结合珠蛋白、铜蓝蛋白、纤溶酶原、补体C4、C3激活物、纤维蛋白原、α-1酸性糖蛋白、α-2-HS-糖蛋白、β-脂蛋白、视黄醇结合蛋白;表达胰岛素受体和胰岛素样生长因子IGFⅡ的受体;该细胞具有3-羟基-3-甲酰辅酶A还原酶和肝甘油三酯脂肪酶的活性。目前尚未证明该细胞中有HBV基因组。
细胞培养方法:
1、细胞传代:细胞密度达到80-90%时即可传代
①弃去培养上清,用PBS或生理盐水清洗1-2次;
②加入2ml0.25%胰酶(T25瓶),使胰酶覆盖整个瓶或皿,盖好放入培养箱消化;
③1-2min后,显微镜下观察细胞,若大部分细胞回缩且有少量细胞脱落,轻轻吹打下确认消化情况后加入完全培养基终止消化;若细胞还是贴壁,放回培养箱继续消化至可以轻轻吹打下为止;
④将细胞悬液1000RPM左右条件下离心4min,弃上清;
⑤用新鲜培养基重悬后加入培养瓶或皿中,T25培养瓶加6-8ml培养基;
⑥悬浮细胞直接离心收集,细胞沉淀重悬后分到新培养瓶中。
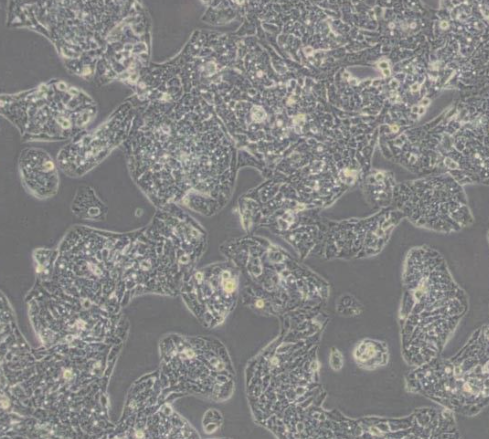
人肝癌细胞
2、细胞复苏:
①将冻存管在37℃温水中快速摇晃融化,时间1min左右,加入4-5ml培养基混匀。
②在1000RPM左右条件下离心4min,弃上清,加1-2ml培养基吹匀,将细胞悬液加入培养瓶中,补加适量培养基。
3、细胞冻存:待细胞生长状态良好时进行细胞冻存保种
①弃去培养上清,用PBS或生理盐水清洗1-2次,加入1mL 0.25%胰蛋白酶(T25瓶)
②1-2min后,显微镜下观察细胞,大部分细胞回缩且有少量细胞脱落,轻轻吹打下确认消化情况后加入完全培养基终止消化;
③将细胞悬液1000RPM左右条件下离心4min,弃上清,加1ml冻存液重悬细胞;
④将冻存管放入程序降温盒,放入-80℃冰箱,4小时后将冻存管转入液氮罐储存。
应用[4][5]
用于蜂毒素诱导保护性自噬对人肝癌细胞生长的影响研究
以人肝癌细胞SMMC-7721、HepG2为研究对象,并建立了肝癌细胞荷瘤鼠模型,在体、内外研究蜂毒素对人肝癌细胞自噬的诱导作用,并分别通过激活和抑制自噬观察蜂毒素对人肝癌细胞增殖、凋亡、细胞死亡的作用,明确自噬在蜂毒素诱导人肝癌细胞死亡中的作用和地位。通过对自噬、凋亡相关通路蛋白的检测,探讨蜂毒素诱导人肝癌细胞死亡可能的相关作用机制,为以后蜂毒素的抗肿瘤研究提供实验基础和思路。
蜂毒素对人肝癌细胞增殖抑制及诱导自噬作用1、MTT法检测不同浓度Mel对人肝癌HepG2、SMMC-7721细胞分别作用不同时间的增殖抑制率;通过倒置相差显微镜观察不同浓度Mel作用人肝癌HepG2、SMMC-7721细胞24h细胞形态变化;通过Annexin V-FIFC/PI双染法检测不同浓度Mel作用人肝癌HepG2、SMMC-7721细胞24h细胞凋亡情况;通过台盼蓝染色法检测检测不同浓度Mel作用人肝癌HepG2、SMMC-7721细胞24h细胞的死亡情况。
2、Western Blot分别检测不同浓度Mel作用人肝癌HepG2、SMMC-7721细胞24h及5μg/mL Mel作用人肝癌HepG2、SMMC-7721细胞不同时间后,LC3Ⅰ/Ⅱ、Beclin 1、p62蛋白的表达;透射电镜检测5μg/mL Mel作用人肝癌HepG2细胞不同时间(0h、24h)后细胞自噬体的形成情况;免疫荧光检测5μg/mL Mel对人肝癌HepG2细胞干预24 h后Beclin 1的表达;对人肝癌HepG2细胞进行pEGFP-LC3质粒转染,激光共聚焦检测Mel对人肝癌HepG2细胞LC3的表达。
自噬机制在蜂毒素诱导人肝癌细胞死亡中的作用1、MTT法、Annexin V-FIFC/PI双染法、台盼蓝染色法检测自噬抑制剂、自噬激活剂单独和联合5μg/mL Mel对人肝癌HepG2、SMMC-7721细胞分别作用24 h后的增殖抑制率、细胞凋亡及细胞死亡情况。
2、自噬抑制剂单独和联合5μg/mL Mel对人肝癌HepG2、SMMC-7721细胞干预后,Western Blot检测Beclin 1复合物及凋亡通路相关蛋白的表达情况。
参考文献
[1]Autophagy-deficiency in hepatic progenitor cells leads to the defects of stemness and enhances susceptibility to neoplastic transformation[J].Feng Xue,Lei Hu,Ruiliang Ge,Lixue Yang,Kai Liu,Yunyun Li,Yanfu Sun,Kui Wang.Cancer Letters.2016(1)
[2]Cancer statistics in China,2015[J].Wanqing Chen,Rongshou Zheng,Peter D.Baade,Siwei Zhang,Hongmei Zeng,Freddie Bray,Ahmedin Jemal,Xue Qin Yu,Jie He.CA:A Cancer Journal for Clinicians.2016(2)
[3]World‐wide relative contribution of hepatitis B and C viruses in hepatocellular carcinoma[J].Catherine de Martel,Delphine Maucort‐Boulch,Martyn Plummer,Silvia Franceschi.Hepatology.2015(4)
[4]Induction of autophagy improves hepatic lipid metabolism in glucose-6-phosphatase deficiency[J].Benjamin L.Farah,Dustin J.Landau,Rohit A.Sinha,Elizabeth D.Brooks,Yajun Wu,Suet Yin Sarah Fung,Tomohiro Tanaka,Masahiro Hirayama,Boon-Huat Bay,Dwight D.Koeberl,Paul M.Yen.Journal of Hepatology.2015
[5]吕灿.蜂毒素诱导保护性自噬对人肝癌细胞生长的影响[D].中国人民解放军海军军医大学,2019.
欢迎您浏览更多关于人肝癌细胞的相关新闻资讯信息