(2R,3R)-2-(2,4-二氟苯基)-1-(1H-1,2,4-三唑-1-基)丁烷-2,3-二醇的合成方法
发布日期:2021/9/28 11:31:43
背景及概述[2]
(2R,3R)-2-(2,4-二氟苯基)-1-(1H-1,2,4-三唑-1-基)丁烷-2,3-二醇是合成艾氟康唑的中间体。艾氟康唑(Efinaconaozle)是首个外用三唑类抗真菌药物,由加拿大DOW制药公司研发,2014年6月6日获得美国FDA批准上市,主要用于治疗由红色毛癣菌、石膏样毛癣菌引起的手、足藓(即灰指甲)。

制备[1-2]
报道一、
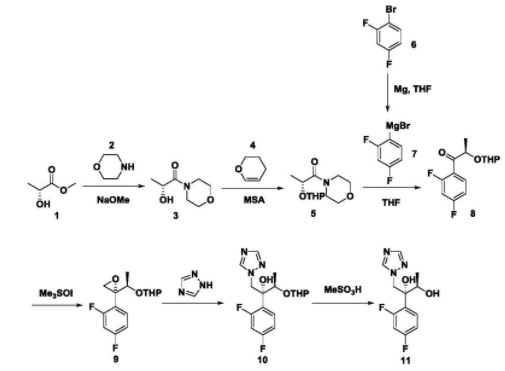
步骤一:化合物3的合成,
将(R)-2-羟基丙酸甲酯(50mmol),甲醇钠(8mmol)用THF溶解,滴加吗啉(100mmol),控温10℃,搅拌3h,TLC监测反应完全后,二氯甲烷萃取两次,有机相用水洗两次,无水硫酸钠进行干燥后,旋干直接用于下一步。1H NMR(CDCl3,300MHz)δ4.43-4.48(m,1H), 3.61-3.83(m,7H),3.42-3.44(m,2H),1.33(d,3H,J=6.8Hz).
步骤二:化合物5的合成,
将化合物3(50mmol)溶于THF中,加入对甲苯磺酸(10mmol),控温5℃,滴加3,4- 二氢吡喃(80mmol),室温搅拌过夜,TLC监测反应完全后,二氯甲烷萃取两次,有机相用水洗两次,无水硫酸钠进行干燥,旋干溶剂,得到淡黄色油状化合物5。1H NMR(CDCl3, 300MHz)δ4.51-4.69(m,2Η),3.86-3.88(m,1H),3.61-3.73(m,8H),3.47-3.50(m,1H), 1.70-1.84(m,3H),1.52-1.56(m,3H),1.41(dd,J=7.0,18.2Hz,3H).
步骤三:化合物7的合成,
将Mg粉(40mmol)溶于无水THF中,加入1粒碘粒做引发剂,控温20℃,滴加化合物6(5mmol),逐步升温至40℃,Mg粉上有气泡冒出,反应引发,降低温度至25℃,继续滴加化合物6(5mmol),约半小时滴加完毕,控温25℃保持1h。
步骤四:化合物8的合成,
向步骤三化合物7的THF溶液中滴加化合物5的THF溶液,控温25℃,滴加过程几乎不放热,15min加毕,继续搅拌30min后,缓慢加入10%盐酸溶液淬灭反应,乙酸乙酯萃取3次,有机相用饱和氯化钠水溶液洗两次,无水硫酸钠干燥后旋干得到淡黄色油状化合物8。1H NMR(CDCl3,300MHz)δ7.85-7.92(m,1H),6.96(dd,J=8.6,7.8Hz,1H), 6.79-6.90(m,1H),4.86(qd,J=6.8,1.2Hz,1H),4.65(t,J=3.6Hz,1H),3.66-3.75(m,1H), 3.28-3.36(m,1H),1.30-1.90(m,6H),1.42(dd,J=6.8,1.2Hz,3H).
步骤五:化合物9的合成,
将三甲基碘化亚砜(50mmol)溶于DMF中,加入化合物8(40mmol),室温搅拌1h, TLC监测反应完全后,反应液无需处理直接用于下一步。
步骤六:化合物10的合成,
将1H-1,2,4-三氮唑(100mmol)溶于DMF中,加入氢氧化钠(100mmol)50℃反应到溶解,降至室温后再加入化合物9的DMF溶液(40mmol)。70℃反应4小时后倒入冰水中,乙酸乙酯萃取3次,有机相用饱和氯化钠水溶液洗两次,无水硫酸钠干燥有机相,旋干后得化合物10粗品,直接用于下一步。
步骤七:化合物11的合成,
将化合物10粗品溶于EA中,控温25℃,加入甲磺酸(MSA,70mmol),搅拌2h,有大量固体析出,过滤得淡黄色固体。取上述固体于EA中,滴加10%NaOH溶液至固体溶解,分液,有机相用饱和NaCl洗两次,无水Na2SO4干燥,旋干得所示产物。1H NMR(DMSO-d6,300MHz) δ8.92(s,1H),8.09(s,1H),7.25-7.19(m,1H),7.18-7.11(m,1H),6.87(td,J=8.46,2.53Hz,1H), 4.80(d,J=14.40Hz,1H),4.72(d,J=14.40Hz,1H),4.19(qd,J=6.31,2.78Hz,1H),2.40(s,3H), 0.80(d,J=6.31Hz,3H).
报道二、
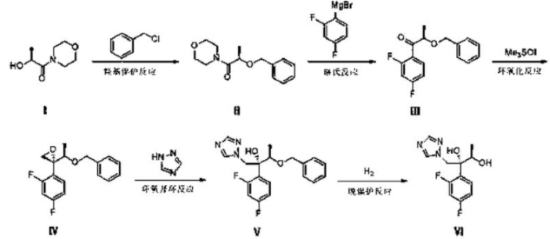
化合物Ⅱ的制备:
向500 mL三口瓶中加入四氢呋喃(80 mL),搅拌下分别加入氢化钠(3.12 g,0.13mol)、化合物Ⅰ(20.67 g,0.13 mol),滴加氯化苄(15.12 g,0.12 mol),滴加完毕后,室温下反应6 h,TLC中控,反应完毕。将反应液用125 mL乙酸乙酯稀释,并依次用水和盐水洗涤。用无水硫酸镁干燥有机相,真空浓缩乙酸乙酯后,得到淡黄色油状液体化合物Ⅱ29.55 g,纯度96.17%,收率91.5%。
化合物Ⅲ的制备:
向500 mL三口瓶中加入镁屑(2.92 g,0.12 mol)、碘粒,使用四氢呋喃(100 mL)稀释2,4-二氟溴苯(23.35 g,0.12 mol)。N2保护下,滴加少量2,4-二氟溴苯,反应引发。低温下,滴加2,4-二氟溴苯,滴加完毕后,保温反应2 h。低温下,将格氏试剂滴加入化合物Ⅱ(27.39g,0.11 mol)中,滴加完毕后,反应过夜,TLC中控反应完毕。将水(100 mL)加入反应液中,搅拌下加入盐酸(2 mol/L)溶液,调节pH值至酸性,真空浓缩除去四氢呋喃,将反应液用100mL乙酸乙酯稀释,萃取分离,并依次用水和盐水洗涤。然后使用无水硫酸镁干燥有机相,真空浓缩乙酸乙酯后,得到黄色油状液体化合物Ⅲ28.30 g,纯度90.0%,收率93.2%。
化合物Ⅳ的制备:
向500 mL单口瓶中分别加入二甲基亚砜(70 mL)、三甲基碘化亚砜(26.4 g,0.12mol)、叔丁醇钾(13.47 g,0.12 mol),室温下搅拌1 h。将化合物Ⅲ(28.3 g,0.1 mol)滴加反应液中,滴加完毕后,反应4 h,TLC中控反应完毕。将反应液用200 mL乙酸乙酯稀释,并依次用水和盐水洗涤。用无水硫酸镁干燥有机相,真空浓缩得到黄色油状液体化合物Ⅳ27.58g,纯度75.3%,收率95.1%。
化合物Ⅴ的制备:
向500 mL单口瓶中分别加入N,N-二甲基甲酰胺(70 mL)、1,2,4-三氮唑(7.2 g,0.1mol)、叔丁醇钾(11.22 g,0.1 mol),室温下搅拌1h,将反应液加入化合物Ⅳ(27.58 g,0.095 mol)中,回流4 h,TLC中控反应完毕。将反应液用200 mL乙酸乙酯稀释,并依次用水和盐水洗涤。用无水硫酸镁干燥有机相,真空浓缩得到黄色油状液体化合物Ⅴ23.90 g,纯度65.0%,收率70%。向化合物Ⅴ加入异丙醇(40mL)、甲磺酸(9.59 g,0.10 mol),搅拌下有固体析出,待固体完全析出后抽滤,得白色固体,化合物Ⅴ磺酸盐19.4 g,纯度99.2%,达到提纯效果。
化合物Ⅴ磺酸盐的氢谱数据:1H NMR (400 MHz, DMSO-d6) δ 7.47 (d, J = 7.2Hz, 2H), 7.40 (t, J = 7.4 Hz, 2H), 7.33 (t, J = 7.2 Hz, 1H), 7.29–7.23 (m,1H), 7.15 (t, J = 11.3 Hz, 1H), 6.89 (t, J = 8.5 Hz, 1H), 4.85 (d, J = 10.4Hz, 1H), 4.72 (t, J = 11.1 Hz, 2H), 4.58 (d, J = 11.7 Hz, 1H), 4.09 (d, J =6.2 Hz, 1H), 2.41 (d, J = 4.5 Hz, 3H), 0.91 (d, J = 6.2 Hz, 3H)。
化合物Ⅵ的制备:
向500 mL三口瓶中分别加入10%钯碳(3.26 g,含水量54.4%)、乙醇(50 mL)、化合物Ⅴ(15.3 g,0.043mol),H2置换两次,保持常压,25-30℃下反应,TLC中控反应完毕。过滤除去钯碳,真空浓缩除去甲醇,将反应液用50 mL乙酸乙酯稀释,并依次用水和盐水洗涤。用无水硫酸镁干燥有机相,得到化合物Ⅵ10.43 g,纯度90%,收率90.1%。
化合物Ⅵ的氢谱数据:1H NMR (400 MHz, CDCl3) δ 7.85 (d, J = 19.8 Hz,2H), 7.42 (dd, J = 15.6, 9.0 Hz, 1H), 6.76 (dd, J = 13.4, 6.9 Hz, 2H), 4.88 –4.76 (m, 2H), 4.34 (qd, J = 6.4, 2.6 Hz, 1H), 0.98 (d, J = 6.4 Hz, 3H)。
参考文献
[1] [中国发明] CN201911212363.0 三氮唑醇类衍生物及其制备方法和应用
[2] [中国发明] CN201911219656.1 一种艾氟康唑中间体的合成方法
欢迎您浏览更多关于(2R,3R)-2-(2,4-二氟苯基)-1-(1H-1,2,4-三唑-1-基)丁烷-2,3-二醇的相关新闻资讯信息



