氯化铝分子的极性
发布日期:2021/6/28 14:26:13
一、何谓极性分子、非极性分子?
在任何一个分子中都可以找到一个正电荷的重心和一个负电荷的重心,根据正电荷重心和负电荷重心重合与否的情况,可以把分子分为极性分子和非极性分子。正、负电荷重心不重合的分子是极性分子,从整个分子来看,电荷的分布是不均匀的、不对称的,如:以极性键结合的双原子分子都是极性分子(HCl、HF、CO等)。反之,正、负电荷重心重合的分子是非极性分子,从整个分子来看,分子里电荷分布是均匀的、对称的,如:同种原子组成的双原子分子都是非极性分子(H2、O2、Cl2等)。
二、判断分子极性的常用方法:
由分子的空间构型是否对称决定分子是否有极性。
1、双原子分子:
(1)单质:
分子内化学键无极性,则为非极性分子,如:H2、O2、Cl2。
(2)化合物:
分子内化学键有极性,则为极性分子,如:HCl、HF、CO。
2、多原子分子:
(1)单质:
多原子单质分子一般为非极性分子,如P4、C60。
(2)化合物:
①中心原子化合价法:
组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子,如:CH4、CCl4、SO3、PCl5。
②受力分析法:
若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子,如:CO2、C2H4、BF3。
三、关于氯化铝
1、氯化铝是离子化合物还是共价化合物?
成键原子吸引电子能力的强弱可用电负性来度量,一般来说,非金属的电负性大于金属的电负性。成键原子的元素电负性相差越大,原子间形成键的极性就越强。一般来说,当电负性差值大于1.7时,形成的化学键为离子键;当电负性差值小于1.7时,形成的化学键为共价键。铝元素的电负性为1.5,氯元素的电负性为3.0,其差值小于1.7,所以氯化铝为共价化合物。且根据氯化铝的物理性质,易升华(沸点:181℃)、易熔化(熔点:194℃),可溶于四氯化碳等非极性溶剂,进一步确认氯化铝是共价分子。
2、氯化铝的分子结构
蒸汽密度表明,气态氯化铝的结构是以双聚分子Al2Cl6的形式存在的。因为铝原子是缺电子原子,氯原子是多电子原子,所以铝原子提供空轨道,氯原子提供孤对电子,形成Cl→Al配位键,每个铝原子周围均为近似四面体配位的氯原子,含有两个三中心四电子氯桥键。成键方式和空间构型如下图所示。
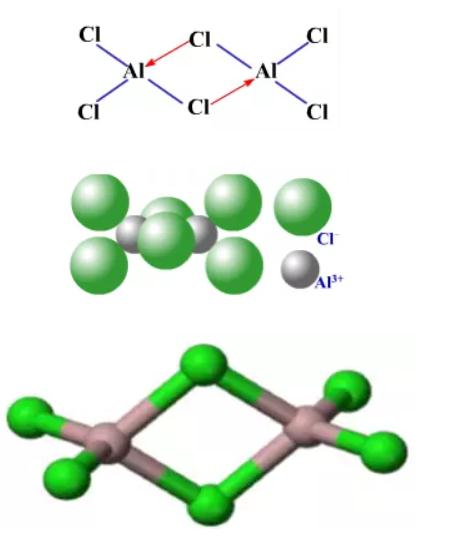
到800℃时,Al2Cl6完全分解为单分子AlCl3,其与BF3结构类似,为平面正三角形。
综上所述,无论是用中心原子化合价法还是用受力分析法解释,都表明氯化铝是非极性分子。
来源: 浦东化学在线



